- Messaggi: 58
- Ringraziamenti ricevuti 6
microbiota intestinale, non mangiamo solo noi
non sapevo esattamente dove inserire questo tread ma alla fine ho scelto nel capitolo alimentazione poiche una delle cose che maggiormente modula il microbiota è proprio l'alimentazione.
sappiamo da sempre che l'alimentazione è una delle basi della salute ma probabilmente quello che non sappiamo è che prima di arrivare a noi quello che mangiamo nutre una colonia
di circa 1Kg e mezzo di microorganismi intestinali, la loro salute è strettamente connessa con la nostra salute e quello che mangiamo influenza in prima battuta la loro salute per poi riflettersi sulla nostra.
da adesso in poi quando mangiate pensate a cosa state dando da mangiare alle vostre bestioline che vivono in simbiosi con voi a da cui dipende la vostra salute.
siete attenti a cosa date da mangiare al vostro animale domestico? fate ancora piu attenzione a cosa date da mangiare a loro.
ho fatto degli articoli sul tema del microbiota che a loro volta hanno tutta una serie di info collegate
questo tread vuole cercare di raccogliere un po tutto
www.luogocomune.net/LC/index.php/21-medi...a-questi-sconosciuti
www.luogocomune.net/LC/index.php/21-medi...blema-microbiologico
www.luogocomune.net/LC/index.php/21-medi...-della-nostra-salute
www.luogocomune.net/LC/index.php/21-medi...guerra-al-microbiota
edit
riflessioni
www.luogocomune.net/LC/index.php/21-medi...o-impazzito#comments
luogocomune.net/LC/index.php/23-energia-...erra-e-il-microbiota
www.luogocomune.net/LC/index.php/21-medi...ndamento-scientifico
www.luogocomune.net/LC/index.php/21-medi...l-seitan-e-un-veleno
connessa alla salute intestinale e quindi intrecciata con la salute del microbiota c'è anche il discorso della vitamina D
www.luogocomune.net/LC/index.php/21-medi...itamina-d-imenticata
sarebbe errato non studiare la vitamina K2 se si integra vitamina D
www.luogocomune.net/LC/index.php/21-medi...a-con-altri-elementi
cerchiamo di tenere il forum ordinato cosi che possa essere di ausilio per chi legge per la prima volta
e per chi è piu addentro servirà a riordinare le idee
buon lavoro a tutti
edit. ovviamente chi ha domande le faccia pure, se saprò , darò risposte altrimenti, magari, qualcun altro saprà darle
fefo
edit
apro questo spazio in testa all'articolo per segnalare link di particolare interesse sull'argomento
un sito interamente dedicato al microbiota
microbioma.it/
una pagina molto interessante sul ruolo del magnesio che potenzia e modula l'azione della vitamina D
www.evolutamente.it/magnesio-in-sinergia...l-cancro-e-la-morte/
il ruolo della vitamina K2 alleata in sinergia con la vitamina D
chrismasterjohnphd.com/2016/12/09/the-ul...vitamin-k2-resource/
EDIT
non me ne vogliano gli utenti di luogocomune ma visto che comunque non prosegue la discussione di fatto continuo l'attività sul mio sito
WWW.PIANETAMICROBIOTA.IT
la verità non si scopre, si capisce.
Si prega Accesso a partecipare alla conversazione.
Il fatto che il nostro corpo sia popolato da microrganismi è risaputo, dal punto di vista della scienza ufficiale, dagli anni ottanta dell'ottocento. Poi, nel corso del novecento si sono scoperte, via via, tutta una serie di specie di microorganismi.
Ma è solo dalla prima decade del ventunesimo secolo che si è affermato il concetto di microbiota, parallelamente al "boom" della ricerca in merito. www.britannica.com/science/human-microbiome . E questo soprattutto a partire dal 2007, con il Human Microbiome Project en.wikipedia.org/wiki/Human_Microbiome_Project , con le nuove tecniche di sequenziamento e con la metagenomica en.wikipedia.org/wiki/Metagenomics .
Sarò un attento lettore di questo forum
"Now go consciously into the breath and let it go. Fully in, letting go, fully in, letting go." (Wim Hof)
χιλικάδο
Si prega Accesso a partecipare alla conversazione.
- Messaggi: 58
- Ringraziamenti ricevuti 6
parliamo di disbiosi intestinale.
c'è un evidente correlazione (forse biunivoca forse no ancora non si sa) tra tanti tipi di patologie.
questo post non vuole riassumerle ma dare un po di info sulla diagnostica.
si misura scatolo e indicano nelle urine cosi da capire se c'è disbiosi e dove c'è (scatolo evidenzia disbiosi nel tratto dell'intestino crasso , l'indicano nel tratto del tenue)
sono due sottoprodotti della decarbossilazione del triptofano.
il triptofano è un amminoacido essenziale molto comune precursore della serotonina che a sua volta è il precursore della melatonina.
il triptofano serve per molte cose oltre che per la sintesi della serotonina quindi troppa disbiosi crea carenze di triptofano con tutto quello che ne può conseguire
la mappa del microbiota è un altro modo per capire la propria disbiosi come è composta, se le famiglie di batteri che portiamo dentro sono sovrapponibile a un campione di controllo sano.
autori come luciano lozio sostengono tuttavia che questa diagnostica è poco utile in quanto il campione di feci raccolto poco può dire se non dell'ultimo tratto intestinale (sigmoideo )
altri test interessanti sono il dosaggio della zonulina fecale o quella plasmatica con la quale si può capire la proprio permeabilità intestinale e la lattoferrina fecale che è un indice di infiammazione.
la lattoferrina è una glicoproteina del latte con proprietà molto interessanti.
capta ferro dal biofilm batterico.
con ogni probabilità stati di disbiosi molto accentuata porta a carenze di ferro in quanto i batteri per proteggersi dai loro litigi tra di loro si ricoprono di biofilm e il ferro è uno dei componenti del biofilm.
una conseguenza della disbiosi è la carenza di ferro per la produzione anomala di questo biofilm.
ecco perche le donne con le mestruazioni sono spesso carenti in quanto il ciclo manda in disbiosi ciclica l'intestino per deprimere un po il sistema immunitario in modo da non essere troppo efficente in quanto sarebbe rigettato un eventuale feto.
lattoferrina per bocca innalza i livelli di ferro nel sangue e quelli di emoglobina (cosa praticamente impossibile con farmaci se non con trasfusioni), è stata testata nel 2008 efficacemente su un gruppo di donne in gravidanza.
un'altra conseguenza di una disbiosi cronica è la permeabilità intestinale.
walter last spiega che in pratica la disbiosi "incattivisce" la candida che da lievito muta in muffa e pianta le sue ife nell'intestino letterlamente bucandolo (creando cosi permeabilità intestinale).
ecco quindi la relazione tra disbiosi e permeabilità attraverso la candida.
personalmente ho fatto un disbiosi test prima e dopo una cura con enterosgel (3 cucchiai al giorno in acqua per 10 giorni , circa due tubi).
l'enterosgel chela metalli tossici (nasce come soluzione all'ingestione di radionuclidi) e altre zozzerie varie.
il risultato è stato un netto calo della disbiosi arrivata da alti livelli a livelli normali.
mi sono quindi chiesto che relazione ci possa essere.
la presenza di metalli tossici manda in disbiosi la flora intestinale?
un possibile approccio è il mineralogramma ovvero il test tessutale (del capello) alla ricerca dei metalli e minerali presenti nel corpo.
sto percorrendo anche questa strada per la soluzione della disbiosi intestinale, ovvero quella di sanificare e detossificare l'intestino (il terreno del microbiota intestinale) da metalli , con vitamina C e oligoelementi in un certo rapporto
vi aggiornerò su sviluppi.
la verità non si scopre, si capisce.
Si prega Accesso a partecipare alla conversazione.
Avresti una tabella di cibi che rimpolpano il microbiota (per es. dopo cura di antibiotici)...il kombucha? Tutta la "roba" fermentata? Quali sono gli alimenti più ricchi di agenti che favoriscono il microbiota?
Slobbysta
La speranza e la preghiera sono un chiedere...MEGLIO INVECE DARE! ...Slobbysta
Si prega Accesso a partecipare alla conversazione.
fino alla maggiore età ho avuto un intestino regolare, poi mi sono "ammalato" di colite.
poi di coliche renali recidivanti pur avendo una dieta equilibrata.
dopo antibiotici cercavo di ripristinare appunto la flora intestinale con fermenti, ecc... a parer mio ora col senno di poi inutile.
dico questo perchè nel momento in cui prendi degli antibiotici tutta la flora (che è innumerevole nel suo equilibrio) viene spappolata. e ripristinare solo una parte crea scompensi ancor maggiori.
ora vengo ad una scoperta che forse, dico forse è, e sta andando bene , solo per me:
dato che i vari farmaci per le coliche renali non sortivano effetto, e sopratutto non cancellavano minimamente la presenza di sangue prima e muco poi. mi sono rivolto all'erborista che mi ha dato un "rimedio del pellegrino" goccie di spaccasasso e bastondoro, appunto per distruggere i cumuli di calcio che ho tendenza a formare (o avevo tendenza dato che fino a 10 anni fa bevevo acque molto dure e probabilmente mi sono portato le conseguenze dietro per anni).
controindicazione del trattamento (90 goccie in 2 litri d'acqua da prendere ogni giorno) il mio intestino è tornato regolare come un orologio, niente più coliche o dissenteria. cerco di capire il perchè e scopro che la soluzione è altamente alcanizzante, e probabimetne quello che sta facendo e depurare il mio copro da una infestazione generale di candida o altri lieviti, sopratutto nel tratto intestinale.
ora alla soluzione ho aggiunto anche zenzero fresco tagliato a fettine e succo di limone. con risultati direi più che apprezzabili.
sine delle coliche e fine della colite.
spero possa funzionare anche con altri problemi intestinali, anche perche il costo complessivo per 2 settimane di terapia (sia rimedio del pellegrino, che zenzero) non supera i 20 euro (e la senzazione di benessere generale è in ogni caso notevolmente aumentata)
Si prega Accesso a partecipare alla conversazione.
- Messaggi: 58
- Ringraziamenti ricevuti 6
tutti cibi fermentati possono dare una mano.
crauti fermentati , umeboshi (da usare come condimento al posto del sale e aceto) , miso , kefir
per quanto riguarda gli yoghurt la loro azione è molto limitata dal fatto che l'ambiente uomo è molto diverso dalla vacca che sta a circa 45 gradi quindi i batteri schiattano di freddo.
appena si sospende si perdono i benefici , nel caso invece dei cibi fermentati possono attecchire e prosperare piccole colonie che poi si stabilizzano quindi il discorso cambia.
la verità non si scopre, si capisce.
Si prega Accesso a partecipare alla conversazione.
- Messaggi: 58
- Ringraziamenti ricevuti 6
per quanto riguarda i fermenti non faccio fatica a crederci.
i probiotici devono essere di derivazione umana e selezionati per essere resistenti all'acidità dello stomaco altrimenti schiattano facilmente in un ambiente
non consono per loro e attaccati dall'acidità dello stomaco durante il transito.
bromatech a oggi che io sappia (a sentire diversi esperti) è la casa che meglio segue queste linee guida
interessante leggere cosa dicono a riguardo
www.bromatech.it/fermenti-lattici.asp
sono convinto anche io che le coliche ovvero la formazione di sassi dentro di noi sia alla fine un risultato di precipitati innescato in qualche modo dal microbiota.
non c'è tuttavia uno straccio di prova, ne si sa realmente perche tutto ciò accade.
la spiegazione dell'acqua dura non mi ha mai convinto perche tutti gli altri che se la bevono e non hanno calcoli?
il mondo del microbiota è un mistero per il 99% in particolare l'interazione con l'organismo e i vari equilibri tra le parti
la verità non si scopre, si capisce.
Si prega Accesso a partecipare alla conversazione.
Mi piacerebbe capire dove trovo questi batteri in forma completa...diciamo il FOS aiuta la proliferazione....e il "fermentato" aggiunge batteri buoni...è corretto?
Secondo te il kéfir essendo un "latticino" ha problemi di temperatura....ma ricordo che il kéfir puoi ottenerlo pure su base vegetale...che ne pensi?
Ciao ...Ante◆Ater
La speranza e la preghiera sono un chiedere...MEGLIO INVECE DARE! ...Slobbysta
Si prega Accesso a partecipare alla conversazione.
- Messaggi: 58
- Ringraziamenti ricevuti 6
gli alimenti fermentati sono una fonte di batteri (oltre che di altri nutrienti) buoni per l'equilibrio intestinale.
più c'è diversificazione e piu il nostro microbiota è sano; questo è il concetto.
quindi una dieta variata (in particolare di cibi fermentati) accresce la diversificazione del microbiota.
riguardo il kefir (o qualunque altro cibo fermentato)
il punto non è latte si o latte no (ovvero ciò di cui si cibano i batteri) , il punto è se i ceppi batterici sono in grado di vivere alle nostre temperature (37).
se non lo sono possono al limite essere efficaci solo nel breve tratto della digestione ma non certo per formare delle colonie permanenti.
so che c'è una kefir di acqua ma francamente non so dirti di cosa campino quesi batteri.
morale della favola pensare che lo yogurth faccia tanto bene è una mezza verità perche può aiutare solo finche lo prendi.
per il kefir francamente non so esattamente che tipo di microorganismi sono ma penso siano diversi da quelli dello yogurth
non so dirti altro, mi spiace, effettivamente le info sono poche e spesso contraddittorie, siamo agli albori dell'era del microbiota a mio avviso.
un idea personale che mi sono fatto è che tutta la fitoterapia prima che apportare sostanze di vario genere impatta sul microbiota modulandolo.
quindi probabilmente gran parte delle azioni riconosciute alle erbe in realtà passa per un azione sul microbiota.
questo di fatto cambia poco la quesione nel senso che l'antica sapienza erboristica rimane di fatto inalterata tuttavia la chiave di lettura sarebbe completamente
capovolta con possibili sviluppi di nuove idee e quindi nuove terapie fitoterapiche alla luce di eventuali nuove comprensioni di questo mondo.
detto in altre parole a mio avviso c'è un enorme spazio di comprensione del mondo del microbiota attraverso la rilettura dell'erboristeria in questa nuova chiave di lettura.
la verità non si scopre, si capisce.
Si prega Accesso a partecipare alla conversazione.
- Messaggi: 58
- Ringraziamenti ricevuti 6
di solito i medici se riscontrano nel paziente carenze di ferro somministrano ferro per bocca con il risultato che spesso e volentieri
non solo non si ottengono i risultati sperati ma si accompagnano diversi sintomi avversi all'integratore di ferro che sconbussola l'intestino.
Quando ho cominciato a sentire quello che diceva paolo mainardi ho cominciato a capire qualcosa di piu.
egli scriveva che è un assurdità pensare che la carenza di ferro c'è per poca assunzione nell'alimentazione e al contempo assurdo pensare che
la causa siano le mestruazioni in quanto le carenze maggiori di ferro avvengono in gravidanza quando il ciclo è interrotto quindi non c'è
nessuna perdita di sangue.
non ci faceva una piega come ragionamento. alcuni medici per mettere una toppa hanno detto che comuqnue la carenza di ferro c'è perche c'è il feto
che si ruberebbe tutto questo ferro.
questa considerazione non mi convince affatto perche non si capirebbe in quest'ottica perche mai carenze di ferro e non di qualunque altro oligoelemento.
Mainardi spiegava che è la disbiosi intestinale a causare le carenze di ferro. il corpo della donna ciclicamente va in disbiosi per immunodeprimersi in modo tale
da non rigettare l'attecchimento di un eventuale feto. (il concetto di disbiosi e immunodepressione non lo sviluppo per non allargare troppo il discorso)in gravidanza
ovviamente in quest'ottica i problemi maggiori sarebbero all'inizio in quanto lo stato disbiotico ha piu ragione di persistere con un feto piccolo .man mano che il bambino si forma
ci sarebbero meno necessità di mantenere uno stato di immunodepressione
però il concetto di disbiosi , da solo, non soddisfaceva al mio desiderio di capirci un po di piu.
mi sono inbattuto in una sperimentazione ufficiale (del 2008) fatta su donne incinta a cui è stata somministrata una glicoproteina del latte: la lattoferrina
dopo appena 30 giorni di trattamento non solo i valori di ferro sono raddoppiati ma anche l'emoglobina è salita di un punto fino a un punto e mezzo.
per chi non lo sapesse NON ESISTE RIMEDIO FARMACEUTICO ALL'EMOGLOBINA BASSA che può essere alzata solamente con le trasfusioni.
spero immaginiate da soli quali problemi si possono accompagnare a delle trasfusioni , in particolare su donne in cinta.
poi la mia attenzione si è focalizzata sulla dottoressa Anju I. Usman che ha suggerito un protocollo antibiofilm/antibiotico per trattare i bambini autistici che presentano tutti piu o meno
disbiosi persistenti e recidivanti con vari sintomi intestinali.
successivamente ho appreso che uno dei componenti essenziali del biofilm dei batteri è proprio il ferro .....a quel punto ho unito tutti i puntini.
lo stato di disbiosi ,ovvero lo squilibrio della flora intestinale ,innesca una sorta di guerra tra microorganismi , un ambiente cioè in cui le varie parti non sono in armonia (eubiosi).
questo significa una cosa molto semplice ovvero che i batteri cercano di sopravvivere come possono usando strategie da batteri.
i batteri quindi si coprono di biofilm ovvero un muco che li rende addirittura mille volte piu resistenti agli antibiotici (ed ovviamente anche ad altre minacce come batteri patogeni concorrenti per lo stesso spazio vitale)
la candida usa un altra strategia ovvero muta il suo stato e da lievito diventa muffa e in questo stato pianta le sue ife nell'intestino creando la cosi detta "permeabilità intestinale".
ecco spiegato in un colpo solo il motivo per cui si può associare la disbiosi intestinale a carenze di ferro(e quindi anche di emoglobina visto che per produrla è essenziale il ferro) e a permeabilità intestinale che a sua volta apre le porte a tutta una serie di problematiche derivanti da una tossiemia a causa di sostanze che non dovrebbero stare nel torrente circolatorio , un esempio tra tanti fegato grasso e allergie alimentari.(ma tanto tanto ancora)
il dosaggio di lattoferrina fecale guarda caso è anche un markers di un analisi per capire se si è in stato di infiammazione intestinale.
perche ?
la spiegazione che mi sono dato è che il corpo in presenza di infiammazioni importanti produce lattoferrina proprio perche c'è un enorme presenza di biofilm.
(senza voler mettere troppa carne al fuoco sottolineo qui come esiste l'uso approvato di escherichia coli nissle 1917 per trattare malattie infiammatorie croniche come chron e colite ulcerosa)
per la cronaca anche gli enzimi possono demolire il biofilm e sempre per la cronaca il biofilm non è malevolo tout court.
anche i bifidi, che sono una delle grande famiglie della nostra flora intestinale, ci si proteggono .
il punto è che quando c'è troppo biofilm è sicuramente perche ci sono guerre microbiche troppo accese in corso,
quindi occorre rimediare.
magari c'è la presenza di troppi ceppi patogeni , oppure la presenza di metalli pesanti che inquinano il terreno in cui vivono i nostri simbionti.
a tal proposito sto anche percorrendo l'idea di un riequlibrio dei minerali e una purificazione da metalli tossici tramite somministrazione orale di vitamina C e oligoelementi mirati a seconda di un analisi tessutale del capello che individua i vari eccessi e carenze.
questa idea mi era venuta constando analisi di disbiosi alla mano prima e dopo una cura di enterosgel ,che è un chelante di metalli pesanti, i valori di disbiosi erano momentaneamente crollati.
tornando alla carenza di ferro ed emoglobina la terapia che ho elaborato si riassume in pratica in un integratore che si chiama tetraglobin (qualcuno evidentemente ci ha già pensato)
che contiene tutto quello che serve per la produzione di emoglobina e per sopperire alle carenze di ferro.
contiene Lattoferrina che ruba ferro dal biofilm batterico e lo rende disponibile una volta arrivato nel torrente circolatorio , acido folico (che interviene nella sintesi di proteine e quindi anche dell'emoglobina) , vitamina C (serve a fissare il ferro) zinco (che non fa mai male perche se ne è quasi sempre carenti ed interviene in oltre 500 processi enzimatici). in piu se siamo di fronte a emoglobina un po basssa può essere utile anche un po di B12 che è fondamentale per la formazione dei globuli rossi.
se invece si ha solo un po di carenza di ferro ci si può limitare a provare lattoferrina pura (ad es. un prodotto che si chiama lattoglobina)
una mia amica che stava sul filo della trasfusione con questo metodo ha rialzato di un punto il suo valore di emoglobina, uscendo almeno per ora dall'emergenza .
mia moglie mi pare che sta avendo buoni risultati ma sono in attesa di analisi che lo confermino.
in ogni caso non ho dubbi che la somministrazione di lattoferrina alzi i valori del ferro (c'è uno studio che ampiamente lo conferma con poi solo lattoferrina e non il resto degli integratori)
il punto è che a mio avviso contribuisce anche a diminuire lo stato di disbiosi in quanto a parità di ferro
assunto con l'alimentazione questo viene "rapito" dalla lattoferrina che quindi non lo rende disponibile per il biofilm.
con meno biofilm si riesce a intervenire in maniera piu efficace con antibiotici naturali, probiotici e/o altro per diminuire lo stato di disbiosi intestinale e con essa la permeabilità intestinale che segue la disbiosi.
per carità non usate antibiotici di sintesi se non proprio necessario e se non sotto controllo medico.
un ultima cosa (se avete capito i ragionamenti è una raccomandazione inutile)
se provate a usare lattoferrina NON assumente anche integratori di ferro a qualunque titolo perche peggiorereste la vostra disbiosi,
l'idea è quella che abbiamo abbastanza ferro con l'alimentazione ma ce lo ruba il biofilm e con la lattoferrina ce lo riprendiamo.
la verità non si scopre, si capisce.
Si prega Accesso a partecipare alla conversazione.
- Messaggi: 58
- Ringraziamenti ricevuti 6
www.mymicrobiota.it/
con un paio di centinaio di euro si effettua un esame molto innovativo (la mappatura del microbiota) , si ha la risposta in circa 30 gg con
la prescrizione del dottor pigoli (di solito una dieta e integratori probiotici).
il dottor pigoli è uno dei medici piu aggiornati sull'argomento microbiota apparso diverse volte su telecolor a medicina amica , spesso insieme a luciano lozio(altro esperto di microbiota e probiotici)
è una delle soluzioni "guidate" che ho trovato piu specializzate sul microbiota
un altro settore interessante è quello dell'analisi dei minerali e metalli tossici all'interno dell'organismo
www.testmineral.it/
centocinquanta euro e si ha una posologia (personalizzata in base all'esame) a base di preparazione galeniche di oligoelementi e vitamina C fatta da gerardo rossi
preparare il terreno al microbiota è una cosa molto sensata.
l'analisi tessutale del capello ha evidenziato bassisimi valori di mercurio in bambini autistici il che fa pensare che ci siano eccessi concentrati in qualche comparto anatomico.
(è impensabile che proprio questi bambini non sono stati esposti al mercurio come risulta dalla stessa analisi in persone sane)
si è anche ipotizzato che la presenza di disbiosi croniche in questi bambini siano una strategia di sopravvivenza del microbiota in quanto certi funghi trattengono il mercurio e quindi lo terrebero lontano dai siti piu delicati in cui sarebbero neurotossici.
insomma c'è una stretta correlazione tra flora intestinale sana e una presenza equilibrata di oligoelementi e assenza di eccessi di metalli tossici.
la verità non si scopre, si capisce.
Si prega Accesso a partecipare alla conversazione.
Dopo la fermentazione, la bevanda di Kombucha è leggermente frizzante e dolciastra, come uno champagne, e contiene vitamine del gruppo B, enzimi, probiotici e un'alta concentrazione di acidi (acetico, gluconico e glucarico). Per via di questi componenti, questa bevanda produce questi effetti:
Migliora la digestioneFavorisce il raggiungimento del peso forma migliorando il metabolismoPurifica e disintossicaRiduce i dolori articolariRafforza il sistema immunitarioAlcalinizzaRingiovanisce
Il “fungo” che permette la fermentazione viene chiamato "Scoby" (colonia simbiotica di batteri e lieviti) ed è la vera e propria “madre” del Kombucha.
L’importanza dei probiotici
I probiotici contenuti nel Kombucha variano molto perché ogni coltura è un essere vivente che cambia a seconda da dove ha avuto origine e di quale nutrimento riceve. In generale però possiamo dire che sono presenti sempre in misura variabile:
GluconacetobacterSchizosaccharomycesBrettanomycesAcetobacterLactobacillusZygosaccharomyces
Questi batteri buoni finiscono nell’intestino dove nutrono e rafforzano la nostra flora intestinale, il famoso “microbiota” che costituisce il secondo cervello. Un intestino sano è la chiave per un umore positivo, una vita emozionale bilanciata e una forte produzione di anticorpi.
Inoltre gli acidi contenuti hanno proprietà anti-invecchiamento e ringiovanenti sulla pelle e sugli organi, combattono l’invecchiamento tissutale con la loro proprietà alcalinizzante e favoriscono la rigenerazione cellulare.
Slobbysta
La speranza e la preghiera sono un chiedere...MEGLIO INVECE DARE! ...Slobbysta
Si prega Accesso a partecipare alla conversazione.
"La causa del morbo di Parkinson potrebbe non risiedere nel cervello, quanto nell’intestino. Alcuni batteri intestinali sembrano infatti giocare un ruolo chiave nell’accumulo di quelle proteine «deformi» che innescano la morte dei neuroni dopaminergici e la conseguente comparsa dei disordini motori."
Da questo sito ...
Una volta è caso, due è coincidenza ma tre è voluto.
Si prega Accesso a partecipare alla conversazione.
Si prega Accesso a partecipare alla conversazione.
- Messaggi: 58
- Ringraziamenti ricevuti 6
www.labiolca.it/images/stories/docs/la-v...94-febbraio-2017.pdf
viviamo immersi nei batteri , in un brodo di batteri...pensare di sterilizzare tutto è un impresa impossibile meglio mirare all'equilibrio e alla cooperazione (dei microorganismi)
la verità non si scopre, si capisce.
Si prega Accesso a partecipare alla conversazione.
- Messaggi: 58
- Ringraziamenti ricevuti 6
ieri ho messo a fuoco un idea ...."La causa del morbo di Parkinson potrebbe non risiedere nel cervello, quanto nell’intestino. Alcuni batteri intestinali sembrano infatti giocare un ruolo chiave nell’accumulo di quelle proteine «deformi» che innescano la morte dei neuroni dopaminergici e la conseguente comparsa dei disordini motori."
il parkinson è una nota mallatia professionale dei pugili.
si è sempre pensato che fossero i pugni in testa che in qualche modo causassero questa degenerazione neurologica ma non si è mai capito bene come.
mettiamo in fila due dati:
a seguito di un trauma cranico c'è il collasso della membrana intestinale
ora consideriamo che recenti studi suggeriscono che determinati batteri intestinali giocano in ruolo nell'accumulo di quelle proteine che innescano la morte dei neuroni dopaminergici e la conseguente comparsa di disordini motori.
possiamo concludere che i traumi cranici(non solo quelli da stress) in qualche modo agiscono sul microbiota intestinale !
la verità non si scopre, si capisce.
Si prega Accesso a partecipare alla conversazione.
- Messaggi: 58
- Ringraziamenti ricevuti 6
microbioma.it/
la verità non si scopre, si capisce.
Si prega Accesso a partecipare alla conversazione.
Più che "indovinare" di gestire le "proporzioni" del microbiota vedere cosa accade interagendo col cibo....
Slobbysta
La speranza e la preghiera sono un chiedere...MEGLIO INVECE DARE! ...Slobbysta
Si prega Accesso a partecipare alla conversazione.
- Messaggi: 58
- Ringraziamenti ricevuti 6
malattia considerata senza cura ha una possibile terapia con probiotici
www.ansa.it/canale_saluteebenessere/noti...cb-40b3d281199f.html
sempre di piu sono convinto che TUTTE le malattie autoimmuni siano connesse in qualche modo al microbiota
la verità non si scopre, si capisce.
Si prega Accesso a partecipare alla conversazione.
- Messaggi: 58
- Ringraziamenti ricevuti 6
cito fonte autorevoleconnessa alla salute intestinale e quindi intrecciata con la salute del microbiota c'è anche il discorso della vitamina D
microbioma.it/immunologia/la-vitamina-d-...robiota-intestinale/
la verità non si scopre, si capisce.
Si prega Accesso a partecipare alla conversazione.
- Messaggi: 58
- Ringraziamenti ricevuti 6
WWW.PIANETAMICROBIOTA.IT
la verità non si scopre, si capisce.
Si prega Accesso a partecipare alla conversazione.

Non ho mai partecipato ma son sempre stato pronto a leggere.
Mitakuye Oyasin
"La violenza è l'ultimo rifugio degli incapaci" (I. Asimov - Il crollo della galassia centrale)
Si prega Accesso a partecipare alla conversazione.
journal.frontiersin.org/article/10.3389/...2014.00147/full#B109
Amici con benefici sociali: le interazioni ospite-microbo come fattore chiave dell'evoluzione e dello sviluppo del cervello?
Roman M. Stilling(1,2), Seth R. Bordenstein(3), Timothy G. Dinan(1,4) and John F. Cryan (1,2*)
(1)Alimentary Pharmabiotic Centre, University College Cork, Cork, Ireland
(2)Department Anatomy and Neuroscience, University College Cork, Cork, Ireland
(3)Departments of Biological Sciences and Pathology, Microbiology, and Immunology, Vanderbilt University, Nashville, TN, USA
(4)Department of Psychiatry, University College Cork, Cork, Ireland
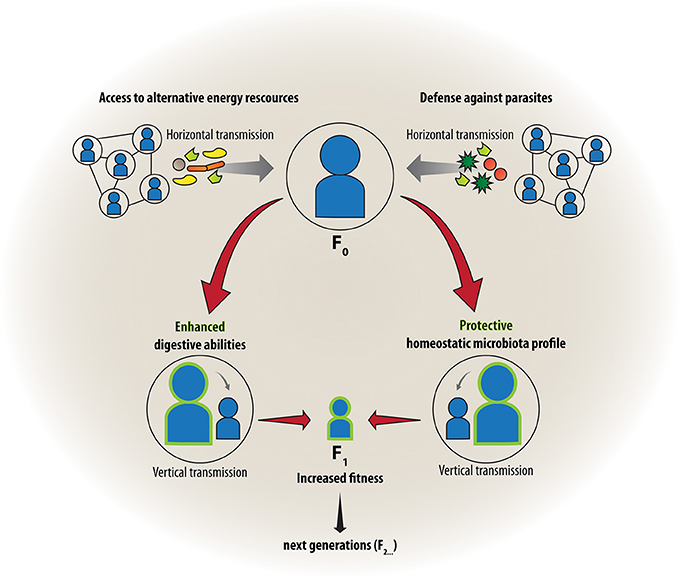
La stretta associazione del corpo umano con migliaia di miliardi di microbi colonizzatori che possiamo osservare oggi, è il risultato di una lunga storia evolutiva. Solo molto di recente abbiamo cominciato a capire come questa simbiosi influisca anche sulla funzione cerebrale e sul comportamento. In questo articolo di ipotesi e teorie, vi proponiamo come le associazioni ospite-microbo possano aver influenzato l'evoluzione e lo sviluppo del cervello dei mammiferi. In particolare, esploreremo l'integrazione dello sviluppo del cervello umano con l'evoluzione, la simbiosi e la biologia dell'RNA, che insieme rappresentano un “triangolo sociale” che guida il comportamento sociale umano e la cognizione. Noi sosteniamo che al fine di capire come la comunicazione inter-regno possa influenzare l'adattamento del cervello e la plasticità, è inevitabile considerare sia i meccanismi epigenetici come importanti mediatori delle interazioni genoma-microbioma su un individuo, sia una scala temporale transgenerazionale. Infine, uniremo queste interpretazioni con la teoria ologenica dell'evoluzione. Considerandole nel loro insieme, proporremo allora una più stretta integrazione dei campi delle neuroscienze con la microbiologia ospite-associato, adottando una prospettiva evoluzionistica.
Introduzione
“IN BIOLOGIA NIENTE HA SENSO SE NON ALLA LUCE DELL'EVOLUZIONE”
(Dobzhansky, 1973)
Sono passati quaranta anni da quando Dobzhansky ha pubblicato il suo famoso saggio volto a difendere il pensiero evoluzionista contro la crescente influenza della fede creazionista (Dobzhansky, 1973). Oggi la fondazione della sintesi neo-darwiniana, che Dobzhansky ha contribuito a portare avanti, è diventata una dei pilastri centrali della biologia moderna e sottolinea la necessità di considerare i processi biologici dal punto di vista dell'evoluzione.
Indagando sulle traiettorie evolutive e genomiche delle specie macroscopiche, i biologi stanno scoprendo sempre di più, che tali vicende non sono solo determinate dai cambiamenti delle frequenze geniche nei genomi nucleari e citoplasmatici, ma in maniera consistente anche dalla variazione genetica nei simbionti unicellulari. Questa può essere allora intesa come parte della genetica totale dell'organismo macroscopico. In tale ottica, le interazioni intergenomiche tra il nucleo e il microbioma sono simili alle interazioni intergenomiche tra il nucleo e i mitocondri, o persino a quelle fra i cromosomi del nucleo. Infatti, sin dalle loro origini, gli eucarioti ed i loro simbionti microbici sono stati e vengono uniti in varie combinazioni, che vanno dall'intracellulare obbligato, ai microbi extracellulari che forgiano interazioni mutualistiche, commensali e parassitarie (Dale e Moran, 2006; Dethlefsen et al, 2007;. McFall -Ngai et al, 2013;. Douglas, 2014). Queste diverse associazioni servono come variazione genomica grezza affinche la selezione naturale possa operare. Proprio come un'interazione gene-gene (ad esempio l'epistasi) emerge da eventi mutazionali nel genoma e può essere oggetto della selezione, lo sono anche le associazioni simbionte-ospite formate e forgiate nel corso del tempo.
Con l'avvento della pluricellularità e degli animali mobili, il fabisogno energetico è aumentato, permettendo alle simbiosi microbiche di intensificare il loro ruolo nella nutrizione e nel metabolismo dell'ospite. Ancora oggi, le influenze microbiche continuano a modellare l'evoluzione degli eucarioti e degli animali. Il microbiota interessa quasi ogni aspetto della forma fisica degli animali in quanto colonizza i loro organi, compresi la bocca, la pelle, gli organi riproduttivi, oppure organi specializzati come i tessuti riproduttivi femminili (Funkhouser e Bordenstein, 2013), l'organo luminescente del calamaro gigante hawaiano Euprymna Scolopes, e altri organi superficiali esposti all'ambiente, con il tratto gastrointestinale che raggiunge le più alte densità di cellule batteriche nei mammiferi (Turnbaugh et al, 2007;.. Dave et al, 2012;. Schloissnig et al, 2013). Nel suo insieme, è importante notare che l'universalità delle simbiosi nell'evoluzione degli eucarioti non elimina i meccanismi canonici della biologia evolutiva, come la selezione naturale, o anche altri livelli di selezione, come quella dei geni egoisti. Piuttosto, la selezione naturale a livelli multipli e le simbiosi stanno operando insieme in modi sottovalutati ma che vengono confermati dalle scienze mature del microbioma.
Il microbiota ospite-associato non è composto soltanto da batteri, ma anche da archeobatteri e da eucarioti, come protozoi, funghi e nematodi. Inoltre, i virus di tutti e tre i domini cellulari, collettivamente denominati viroma, possono essere trovati nel microbiota (Virgin, 2014). I progetti su larga scala di sequenziamento microbico come l'Human Microbiome Project (HMP) (Turnbaugh et al, 2007;. Human Microbiome Project Consortium, 2012), l'European MetaHIT (Qin et al., 2010), e il progetto Eldermet (la definizione della composizione microbica in relazione all'invecchiamento, Claesson et al, 2012) hanno contribuito a identificare il microbiota umano-associato, consistente di almeno 40.000 ceppi batterici, divisi in 1800 generi (Luckey, 1972; Frank e Pace, 2008; Forsythe e Kunze, 2013), che ospitano collettivamente almeno 9,9 milioni di geni non umani (Li et al., 2014). Portandoli a circa 500 volte i geni umani codificanti-proteine attualmente annotati ( www.ensembl.org ), i 100 trilioni di cellule non umane associate costituiscono 1-2 kg del peso di un corpo adulto (Forsythe e Kunze, 2013), paragonabili al peso del cervello umano adulto (ca. 1,5 kg, Parent e Carpenter, 1996).
Quest'ultima comparazione, ossia l'analogia col peso del cervello, non è un arbitrario esercizio di numeri. E' piuttosto una finestra sul rapporto tra le neuroscienze e la microbiologia. Durante l'evoluzione umana, il cervello dei primati ha subito ricostruzioni strutturali, in termini di aumenti rapidi e marcati in volume relativo, portandolo ad essere l'organo più esigente di energia (Khatri e Man, 2013). Curiosamente, è stato osservato che allo stesso tempo, il tratto gastrointestinale è andato riducendosi, portando all'“ipotesi del tessuto costoso” (Aiello e Wheeler, 1995), la quale propone come compensazione per la crescita di un organo metabolicamente oneroso, la riduzione di un altro. Mentre quest'ultima ipotesi è stata contestata (Navarrete et al, 2011;. Warren e Iglesias, 2012), studi recenti dimostrano che la presenza e la tipologia di microrganismi in un dato individuo ospite, non solo ha molteplici e cruciali conseguenze per i suoi processi fisiologici, come lo sviluppo postnatale e l'immunomodulazione, ma influisce sorprendentemente anche sullo sviluppo neurologico, sul comportamento e sulla cognizione (Cryan e Dinan, 2012).
Alla luce di queste nuove prove e dati, provenienti da studi cognitivi di neurogastroenterologia (ad esempio, Cryan e O'Mahony, 2011), esploreremo la possibilità che le associazioni ospite-microbo influenzino significativamente l'evoluzione e lo sviluppo del cervello dei mammiferi. Inoltre sosterremo che per comprendere la comunicazione transgenerazionale inter-regno e suoi effetti sull'adattamento del cervello e sulla plasticità, è inevitabile considerare i meccanismi epigenetici come importanti mediatori di queste interazioni ospite-microbo.
Le interazioni genoma-microbioma e l'evoluzione animale
"C'E' UN ERRORE FONDAMENTALE NEL SEPARARE LE PARTI DAL TUTTO, L'EQUIVOCO DI ATOMIZZARE QUALCOSA CHE NON DOVREBBE ESSERE ATOMIZZATA. L'UNITÀ E LA COMPLEMENTARITÀ COSTITUISCONO LA REALTA'"
(Werner Heisenberg, 1930)
Secondo un dogma di lunga data nel campo della biologia, il primo contatto di un mammifero con i batteri si verificherebbe durante la nascita attraverso il canale del parto. Tuttavia, vi è un numero crescente di prove che dimostrano come la trasmissione di alcuni microbi si verifica già nel grembo materno. Quindi il paradigma dell'utero sterile risulta antiquato (Funkhouser e Bordenstein, 2013). Inoltre, la flora intestinale della madre cambia drasticamente durante la gravidanza (Koren et al., 2012). Dopo la nascita avvenuta attraverso il canale del parto, il microbiota diventa più complesso e abbondante, e questi cambiamenti nella formazione batterica proseguono con l'allattamento al seno e con l'assorbimento di nuovi microbi dall'ambiente (Koenig et al., 2011). Non c'è da sorprendersi se il microbiota influenza significativamente lo sviluppo pre-natale, peri-natale e post-natale, e che le variazioni intervenute nelle prime fasi di vita si tradurranno in alterazioni fenotipiche in età adulta (Borre et al., 2014). Del resto, le successioni microbiche durante lo sviluppo degli animali sono ben dimostrate (Koenig et al, 2011;. Brucker e Bordenstein, 2012b;. Pantoja-Feliciano et al, 2013) e possono essere influenzate da vari fattori ambientali come la dieta, lo stile di vita o l'habitat (Marques et al., 2010).
La colonizzazione del microbiota può dipendere dalla genetica dell'ospite, e vi è oggi un interesse crescente nel chiarire il contributo relativo dell'ambiente e dei geni ospiti sull'insieme delle comunità microbiche ospite-associate. In particolare, il genoma ospite potrebbe filtrare i microbi ambientali nei tessuti dell'ospite, come una forma di addomesticamento simbiotica per ogni generazione, e reciprocamente, i microbi ambientali potrebbero preferire di occupare specifici lignaggi di ospiti (Brucker e Bordenstein, 2012A). Diversi studi hanno indagato le associazioni genoma-microbioma (Dethlefsen et al, 2007;. Arumugam et al, 2011;. Moeller et al 2012), e studi di laboratorio su sistemi modello stanno cominciando a essere utilizzati per verifiare le influenze del macro e del microambiente sul complesso della flora intestinale, portando con ciò allo scavo dell'influenza intrinseca che la genetica dell'ospite ha sul complesso del microbiota lungo le specie. Formazioni microbiche differenziali si verificano fra specie strettamente collegate anche quando vengono mantenute nello stesso regime dietetico e sotto identiche condizioni di allevamento (Brucker e Bordenstein, 2012b;. Franzenburg et al, 2013), e le relazioni comunitarie del microbioma di ogni specie corrono in parallelo con le relazioni filogenetiche del genoma dell'ospite, uno schema chiamato “filosimbiosi”, sul modello dell' insetto Nasonia (Brucker e Bordenstein, 2013b). Inoltre, nelle prime fasi embrionali del metazoa Hydra (uno cnidario che si riproduce asessualmente), dei peptidi antimicrobici specializzati regolano in parte la filosimbiosi fra specie affini (Fraune e Boch, 2007; Franzenburg et al 2013). E 'stato anche dimostrato che la particolarità della relazione interspecifica tra l'ospite e il microbo, è necessaria per il corretto sviluppo del sistema immunitario nei topi (Chung et al., 2012).
All'interno delle specie, vi sono differenze nel microbioma che possono essere attribuite ai polimorfismi a singolo nucleotide (SNP) o a variazioni del numero di copie geniche (CNV) (Rausch et al, 2011;. Tong et al, 2014;.. Wacklin et al 2014 ). Come tale, la variazione genetica fra i ceppi di topo è responsabile delle variazioni nella flora intestinale (Benson et al, 2010;.. Kovacs et al, 2011). Per quanto riguarda gli esseri umani, ci sono prove che la composizione del microbiota è maggiormente simile in individui strettamente imparentati, come i gemelli monozigoti, ed è correlata con l'appartenenza etnica (Ravel et al, 2011..; Mason et al, 2013) (Zoetendal et al., 2001). Comprendere l'interazione fra le dinamiche colonizzatrici dei microbi, la genetica umana, e le malattie complesse, fra cui i disturbi psichiatrici e del neurosviluppo (es, i disordini dello spettro autistico - ASD, la schizofrenia e la depressione), è uno sforzo importante per definire in ultima analisi, i fattori genetici di rischio per una composizione microbica potenzialmente fatale (Spor et al., 2011). In generale, le interazioni genotipo-enterotipo potrebbero essere una determinante chiave della variazione microbica fra gli individui. Tenendo a mente la tendenza progressiva verso i trattamenti di trapianto fecale (Borody e Khoruts, 2012), oggi fattibili con sospensioni fecali congelate depositabili in specifiche bio-banche (Youngster et al., 2014), le combinazioni genoma ospite-microbioma dovrebbero essere considerate incompatibili o comunque dannose, e di conseguenza le coppie donatore-ricevente dovrebbero essere esaminate prima del trapianto fecale.
In conclusione, la selezione intrinseca dell'ospite sul microbiota mostra le caratteristiche di un fenotipo esteso codificato dal genoma nucleare. Il concetto di “fenotipo esteso” è stato introdotto da Richard Dawkins per includere gli effetti modulatori sull'ambiente come parte del fenotipo di un gene che si estende oltre la modulazione delle cellule in cui viene espresso (Dawkins, 1983). Come i fenotipi di cui stiamo discutendo hanno essi stessi dei genomi, l'analogia è più opportunamente ampliata ad un genoma esteso che codifica le caratteristiche essenziali mancanti nel genoma ospite. Secondo questa prospettiva, le simbiosi in generale e le endosimbiosi microbiche in particolare, possono essere viste come il complemento essenziale dell'attività mancante del genoma nucleare di un organismo, una visione compatibile con il concetto di ologenoma, introdotto per primo da Rosenberg et al. (2007). Questo concetto considera il genoma dell'ospite ed il suo microbioma, come il genoma totale di un organismo, in cui la somma genetica di tutti i membri può influenzarne la forma fisica, ed è quindi un'unità di selezione solo di recente apprezzata, che va ad interessare l'adattamento e la speciazione (Rosenberg et al, 2007;. Brucker e Bordenstein, 2013a). Pertanto, il concetto di ologenoma abbraccia la visione genocentrica contemporanea della vita, ma l'aggiorna considerando il microbioma come un aspetto centrale della genetica di un organismo. A detta di tutti, questo punto di vista sfuma le differenze tra il genoma e l'ambiente. Abbraccia una visione vivace e più soddisfacente della natura della biologia, dove il microbioma è essenziale quanto il genoma nel definire cosa un animale, o una pianta, sono e non sono.
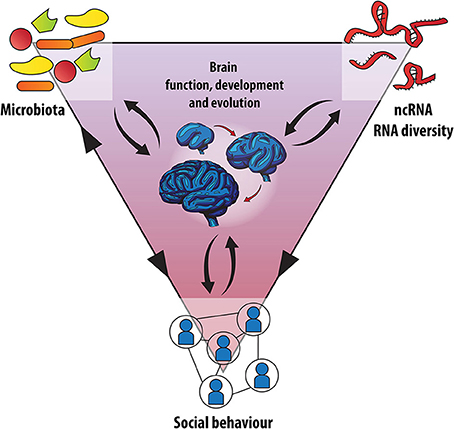
La rete sociale: Microbioma, RNA e l'Evoluzione del Cervello Sociale
“LA VITA NON SI E' DIFFUSA SULLA TERRA ATTRAVERSO LA LOTTA, BENSI' CON LA FORMAZIONE DI RETI”
(Margulis and Sagan, 1986)
Menti che pensano allo stesso modo: i vantaggi dei cervelli sociali
Molte specie di mammiferi si sono evolute per abbandonare la vita solitaria e formare gruppi sociali di individui cooperativi. La vita di gruppo offre una serie di vantaggi che vanno dalla protezione reciproca, alla ricerca cooperativa di cibo, oltre che per ottenere un partner per l'accoppiamento. E' verosimile che il sostegno durante l'allevamento della prole possa mostrare un vantaggio evolutivo nei gruppi di tipo familiare, come previsto dalla teoria della selezione parentale. Questa è uno schema matematico che fornisce una spiegazione per l'apparente paradosso dell'investimento altruistico di risorse per aiutare l'allevamento della prole di parenti stretti (Hamilton, 1964). Tuttavia, la vita di gruppo pone anche alcune sfide alla fisiologia e al comportamento degli individui che appartengono ad un gruppo sociale. Come tali, i membri del gruppo devono riconoscersi a vicenda, il che richiede l'interazione nel cervello dei sistemi visivi e della memoria. La necessità di pianificare e organizzare iniziative cooperative, come ad esempio la caccia, osservata nei mammiferi che vivono in gruppo, quali lupi, leoni e alcuni primati, comporta anche un riconoscimento di ciò che gli altri individui sanno, vedono o sentono. Questa forma di empatia o “teoria della mente” è una caratteristica molto sviluppata negli esseri umani e solitamente disturbata nei disordini del neurosviluppo dello spettro autistico (Baron-Cohen, 2009). Inoltre, i meccanismi neurobiologici per comportamenti come quelli legati all'affettività, devono essere attuati nei cervelli degli individui sociali per garantire legami sociali all'interno del gruppo.
Pertanto, i cervelli delle specie sociali presentano una serie di aspetti comuni che hanno bisogno di lavorare insieme per diventare vantaggiosi nella vita di gruppo. Delle aree del cervello, come la corteccia prefrontale o l'amigdala, hanno subito mutazioni pronunciate durante l'evoluzione dei mammiferi sociali come gli esseri umani (Hrvoj-Mihic et al., 2013). Verso tale sorte sono andati anche sistemi neuroendocrini quali la vasopressina e l'ossitocina. Quest'ultima, a volte indicata come “l'ormone sociale”, è importante nella vita di gruppo per sostenere l'affetto e l'empatia fra i suoi membri (Insel, 2010; Meyer-Lindenberg e Tost, 2012 ; Lukas et al, 2013;.. Skuse et al, 2014). Inoltre, viene sempre più considerato il fatto che l'ambiente sociale è strettamente associato con la suscettibilità a problemi di salute mentale e che la vita metropolitana sia più dannosa rispetto alle comunità rurali compatte (Lederbogen et al., 2011).
Anche le relazioni fra gli individui della stessa specie, nonché il comportamento nei confronti di altre specie, sono un fattore ambientale chiave che influenza il microbiota specifico di un individuo. L'isolamento sociale o la negligenza materna possono portare a gravi disturbi legati allo stress della flora intestinale, la quale potenzialmente può mediare ulteriori reazioni fisiologiche avverse connesse a situazioni di stress (Bailey e Coe, 1999; O'Mahony et al, 2009;.. Bailey et al, 2011). Infatti, anche dal punto di vista inverso, il microbiota e la vita sociale potrebbero essere più strettamente collegati di quanto generalmente si crede.
Il Pool Genetico in Espanzione: Il Ruolo dei Microbi nell'Evoluzione della Vita Sociale di Gruppo
A differenza del genoma nucleare, il nostro microbioma è contagioso. Cellule microbiche possono lasciare attivamente o passivamente il corpo e diffondersi in nuovi habitat e ospiti, e da un prospettiva evoluzionistica è possibile presumere che la selezione naturale ha favorito quei microbi che incrementano la propria trasmissione. D'altra parte, lo scambio di microbi per contatto intimo tra conspecifici potrebbe offrire vantaggi anche per l'ospite. Queste caratteristiche del microbioma hanno spinto alcuni autori a ipotizzare che il comportamento sociale si è, almeno in parte, evoluto per migliorare la trasmissione dei microbi (Troyer, 1984; Lombardo, 2008; Ezenwa et al, 2012;.. Montiel-Castro et al, 2013). In quanto tale, può essere vantaggioso per trasferire simbionti benefici, i quali vengono utilizzati dai destinatari sia per aumentare la resistenza contro agenti infettivi e tossine, oppure per aumentare le capacità di digerire una gamma più ampia di alimenti. Lombardo ha fatto riferimento a questo “accesso ai microbi endosimbiontici mutualistici” come una forza trainante per l'evoluzione della socialità negli animali (Lombardo, 2008). Mentre la capacità microbo-dipendente di elaborare diete vegetali è stata particolarmente importante per le specie erbivore (Troyer, 1984), la protezione da parassiti e patogeni è stata indicata come aspetto rilevante nel guidare il comportamento sociale dei non-erbivori (Lombardo, 2008). Verosimilmente questi ultimi realizzano scambi di microbi che contribuiscono al metabolismo secondario, producendo tossine o antibiotici che aiutano a fornire una difesa contro parassiti, o a degradare xenobiotici tossici e a creare un sano microambiente omeostatico (Douglas, 2014) (Figura 1, lato destro). Tra l'altro, alcuni componenti microbici, come il materiale della parete cellulare dei batteri o altri schemi molecolari microbo-associati (MAMPs), (Ausubel, 2005) sono riconosciuti dal sistema immunitario e così preparati negli scontri con i microbi patogeni o indesiderati (Chung et al., 2012; Lee e Mazmanian, 2014). Montiel-Castro et al. hanno ulteriormente discusso il ruolo evolutivo di specifici comportamenti sociali, come baciarsi, pettinarsi e il rapporto sessuale, nel miglioramento della trasmissione di microbi per la colonizzazione selettiva (Montiel-Castro et al., 2013) e solo recentemente si sono focalizzati sul ruolo dei microbi nella formazione delle decisioni sociali e socio-economiche (Montiel-Castro et al., 2014). Sebbene i meccanismi socio-comportamentali di scambio di simbionti saranno pur sempre oggetto di dirottamento condotto dai parassiti, dobbiamo presumere che lo scambio di microbi benefici sia quello prevalente, considerando il fatto che non c'è mai stata per l'evoluzione, l'opzione selettiva contraria a tutti i simbionti.
Queste nozioni sono particolarmente interessanti se consideriamo l'ipotesi del “cervello sociale” dell'antropologo inglese Robin Dunbar. Questa presuppone un rapporto positivo causale tra le dimensioni della neocorteccia e il comportamento sociale all'interno dei primati, come un fattore critico che contribuisce all'evoluzione dell'intelligenza umana (Dunbar, 1998). L'ipotesi di Durban pertanto conduce alla speculazione che un'accresciuta trasmissione di microbi attraverso la vita di gruppo possa aver contribuito al progressivo aumento della dimensione e della funzione corticale. Studi che indagano la divergenza del microbioma lungo le traiettorie evolutive di speciazione necessiterebbero di dimostrare la corrispondenza filogenetica dell'ospite e del simbionte per aiutare ad aggiornare tale ipotesi (Dale e Moran, 2006;. Zaneveld et al, 2008; Fitzpatrick, 2014). Un recente studio comparativo tra i microbiomi degli scimpanzé e degli esseri umani è un primo passo in questa direzione (Moeller et al., 2012) e rende tale svolta particolarmente interessante per la biologia comparata nel considerare le differenze del microbiota come facilitatrici della filosimbiosi con riferimento alla complessità sociale.
Reti Regolatrici di RNA
Strettamente connesso con la rapida espansione della neocorteccia durante l'evoluzione dei primati, il genoma umano ha visto un evoluzione accelerata, soprattutto in determinate regioni non-codificanti-proteine. Con l'avvento delle tecnologie di sequenziamento dell'intero trascrittoma, abbiamo potuto apprendere che molte di queste regioni in realtà contengono preziose informazioni. E' interessante notare che la maggior parte di queste regioni vengono trascritte nell'RNA, sebbene con funzione spesso sconosciuta o non assegnata. Eppure, vi è un costante aumento di prove che questi RNA non-codificanti (ncRNAs) hanno un potente impatto normativo sul panorama trascrizionale della cellula. Essi vengono raggruppati in piccoli (<200 paia di basi) ed RNA lunghi non-codificanti (>200 bp). Gli RNA piccoli si sono costituiti per primi durante l'evoluzione (sappiamo che i procarioti li utilizzano; Liu et al, 2012;. Mika e Hengge, 2013) e sono ulteriormente divisi in vari sottogruppi, sopratutto RNA microscopici (miRNA), piccoli RNA interferenti ( siRNA) ed RNA piwi-interacting (piRNAs), che insieme funzionano nella regolazione post-trascrizionale dell'espressione genica, interferendo con le trascrizioni primarie. Gli RNA lunghi non-codificanti (lncRNA), tuttavia, appaiono molto più tardi nell'evoluzione e si trovano solo nelle piante e negli animali. Infatti, circa un terzo dei lncRNAs noti sembrano essere specifici dei primati (Derrien et al, 2012;. Barry, 2014). È importante notare che il cervello non è solo la sede principale di espressione dei lncRNAs, ma anche di altri meccanismi di regolazione basati sull'RNA, che include lo splicing alternativo, l'editing dell'RNA e la metilazione dell'RNA (Paul e Bass, 1998;. Meyer et al 2012 ; Li et al, 2013;.. Niu et al, 2013), la maggior parte di quelli che hanno un maggiore rilievo nel genoma umano, sono particolarmente prevalenti nel cervello umano, e sono dunque candidati promettenti per un ruolo chiave nell'evoluzione dei processi del neurosviluppo e del comportamento sociale umano complesso e della cognizione (Colpo et al, 2004;. Xing e Lee, 2006; Lin et al, 2010;. Barry e Mattick, 2012; Qureshi e Mehler, 2012).
Insieme, sia il miglioramento dellla trasmissione microbica attraverso la vita di gruppo e sia l'espansione della regolazione dell'RNA non-codificante, hanno verosimilmente contribuito a far progredire il comportamento sociale nei primati e, in ultima istanza, l'intelligenza umana (Figura 2). Comunque, sarà interessante capire se questi due sistemi si svilupparono in parallelo e indipendentemente, o se la coevoluzione ospite-simbionte abbia avuto un impatto sullo sviluppo di una regolazione dell'RNA più complessa e viceversa (Figura 2). Sulla base di questo, prevediamo che disbiosi durante lo sviluppo, o la completa assenza di microbi durante una vita priva di germi possano portare, fra vari effetti e attraverso meccanismi che devono ancora essere identificati, a una deregolamentazione dei processi chiave basati sull'RNA necessari per la normale maturazione del cervello e del suo funzionamento.
Microbiota, RNA Networks e lo Sviluppo del Cervello: un triangolo sociale?
Per chiamare in causa una potenziale interazione tra le reti di RNA e il microbiota nello sviluppo neurologico e nell'evoluzione dei comportamenti sociali, sarà utile considerare due tipi di contesti sperimentali. In primo luogo, gli scenari nei quali i disturbi delle capacità sociali di un ospite devono essere indagati in relazione ai cambiamenti del microbiota e della regolazione genica basata sull'RNA. Secondariamente, gli effetti dell'assenza di microbi o di una composizione disturbata del microbiota (disbiosi) sui meccanismi basati sull'RNA e qui il comportamento sociale sarà decisivo per definire le basi genetiche di questo triangolo sociale (Figura 2).
Per quanto riguarda il primo, fra i disturbi più pronunciati del comportamento sociale ed emotivo ci sono i disordini all'interno dello spettro autistico. Da un lato, gli ASDs e gli altri disturbi dello sviluppo neurologico sono stati da poco associati con un ridotta funzione degli ncRNAs (Mellios e Sur, 2012;. Van De Vondervoort et al, 2013; Ziats e Rennert, 2013). Dall'altro, una ricerca recente suggerisce che i disturbi dello sviluppo neurologico, come ASDs, sono strettamente interconnessi con la flora intestinale. Nonostante in questo momento rimanga sconosciuto ciò che ne è la causa e quale conseguenza comporti, il sintomo più comune degli ASDs - la carenza di comportamento pro-sociale – viene spesso accompagnato da sintomi gastrointestinali (GI) e da alterazioni nella composizione e della funzione del microbiota (Ming et al, 2012;. Cao et al, 2013). Curiosamente entrambe le tipologie di sintomi, quella del sistema nervoso centrale (CNS) e quella gastrointestinale, di solito accadono contemporaneamente nei modelli animali per l'ASD e sembrano dipendere dalle interazioni ospite-microbo (Hsiao et al, 2013;.. Desbonnet et al, 2014).
Alcune prove correlative di un'interazione fra microbiota e l'editing dell'RNA proviene da uno studio su topi geneticamente obesi leptina-deficienti (ob/ob), noti per ospitare un microbiota diverso rispetto ai topi magri (Turnbaugh et al., 2006), i quali mostravano un editing alterato del recettore della serotonina Htr2c dell'mRNA localizzato nell'ippocampo e nell'ipotalamo (Schellekens et al., 2012). E' interessante che questi siti di mRNA-editing siano per l'appunto conservati negli esseri umani e che alterazioni nella frequenza di editing abbiano mostrato d'essere associate con la schizofrenia (Burns et al, 1997;.. Dracheva et al, 2003), sebbene la regolazione negli esseri umani sembra essere più complessa a causa dello splicing alternativo della cassetta di editing. Anche la metilazione dell'RNA potrebbe essere legata alla composizione del microbiota tramite il metabolismo, dal momento che una delle due demetilasi note dell'RNA,il gene associato alla massa grassa e all'obesità (Fto - Fat mass and obesity associated), è ritenuto come strettamente collegato all'indice della massa corporea nell'uomo (Speakman, 2013; Zheng et al., 2013).
Al fine di dare uno sguardo più ravvicinato al secondo contesto sperimentale, vale a dire, gli effetti dell'assenza di microbi sulle capacità sociali, abbiamo recentemente dimostrato che i topi privi di germi sono largamente carenti in termini di comportamento pro-sociale e di cognizione sociale (Desbonnet et al., 2014). Il topo privo di germi trascorre molto meno tempo con un altro esemplare della stessa specie, e quando deve scegliere un compagno, non mostra la tipica preferenza per un topo che non ha mai incontrato prima, rispetto ad un altro individuo già noto. Mentre la socialità poteva essere aiutata dall'introduzione di un normale microbiota post-svezzamento, la memoria di riconoscimento non era suscettibile da un rifornimento di microbiota, ciò suggerisce l'esistenza di una finestra temporale di sviluppo critico che consente agli impulsi microbiota-dipendenti di agire sul sistema nervoso centrale e sulla creazione di abilità sociali (Desbonnet et al., 2014). Una socialità ridotta, sebbene meno pronunciata rispetto al topo di laboratorio, è stata anche dimostrata nei ratti privi di germi (Crumeyrolle-Arias et al., 2014). Esperimenti futuri dovrebbero concentrarsi sulla regolazione dinamica dell'espressione genetica e specialmente sul ruolo dell'RNA regolatore in questi animali, con particolare attenzione alle regioni del cervello coinvolte nel comportamento sociale.
Presi insieme, questi concetti supportano un modello in cui l'evoluzione della socialità umana, che venne accompagnata da un estensione accelerata della neocorteccia, è un esempio chiave di co-evoluzione ospite-microbo, ed è dipesa dai segnali endosimbiontici dello sviluppo attraverso l'asse microbiota-intestino-cervello (Figure 2). Lo sviluppo del prosencefalo, specialmente la neocorteccia, nei mammiferi sociali e in definitiva nei primati e negli esseri umani, dipende da segnali corretti e puntuali forniti da simbionti microbici. Tali segnali sono disturbati, quando c'è assenza, o c’è disordine del microbiota, come si è visto nei modelli artificiali privi di germi, o in contesti più naturali come il taglio cesareo, o durante lo stress prenatale, perinatale e postnatale (Gilbert et al, 2010;.. Borre et al, 2014).
Ma quali sono questi segnali ambientali a cui provvede il microbiota per lo sviluppo del cervello dell'ospite? E come possono interferire con i meccanismi basati sull'RNA? Nelle successive sezioni esamineremo le evidenze scientifiche che mostrano come i meccanismi epigenetici di regolazione genica, oltre alla modulazione dei sistemi di neurotrasmissione offrono un'interfaccia adatta per le interazioni ospite-microbo. Per fare ciò, prima esploreremo il modo in cui i meccanismi epigenetici plasmano l'evoluzione darwiniana, e poi ci concentreremo sul macchinario epigenetico molecolare che fornisce l'interfaccia d'interazione con tali meccanismi, la quale consente al microbiota di influenzare l'evoluzione e lo sviluppo del cervello sociale.
Meccanismi Epigenetici in Evoluzione: Natura e Cultura
“EPIGENETICA E' UN TERMINE UTILE SE NON SAI COSA STA SUCCEDENDO – SE LO SAI, USA QUALCOS'ALTRO”
(Adrian Bird, 1995)
Oltre alla variazione genetica microbo-indotta come il trasferimento genico laterale (TGL, vedi Box 1), i meccanismi epigenetici simbionti-dipendenti possono generare varietà ereditabili entro poche generazioni, potendo ridurre la quantità di linea germinale TGL necessaria per effettuare modifiche simbionte-indotte sullo sviluppo dell'ospite entro scale di tempo più brevi.
Box 1. Trasferimento genico laterale (TGL) come fonte di variabilità selezionabile.
Le interdipendenze interspecifiche non si verificano solo tra ospite e microbi, avvengono anche fra i singoli microbi, ossia tramite catene metaboliche e complementarità genomica, dove metaboliti e prodotti genici vengono condivisi per sopperire a quelli mancanti nei partner interagenti. In aggiunta agli scambi chimici o di peptidi, il materiale genetico può essere scambiato tra il microbo e l'ospite. Dal punto di vista della teoria ologenetica, i microbi ospite-associati rappresentano un continuum di interazioni simbiotiche che inizia con gli organelli batterio-derivati e termina con gli endosimbionti e i microbi extracellulari. Lungo la traiettoria evolutiva dei primi eucarioti, la maggior parte del cloroplasto e dei geni mitocondriali sono stati trasferiti nel genoma nucleare. Mentre le interazioni fra il nucleo degli eucarioti e i microbi extracellulari sono certamente meno intime, è stato notato che il trasferimento genico laterale interspecifico (TGL, noto anche come trasferimento genico orizzontale) continua a verificarsi anche tra i genomi eucariotici, virali e procariotici (Salzberg et al, 2001;.. Robinson et al, 2013; Overballe-Petersen e Willerslev, 2014). E' chiaro che i geni virali hanno fortemente contribuito all'evoluzione del genoma degli animali e al loro adattamento. Si stima che fino all' 8% del genoma umano sia di origine virale (Belshaw et al., 2004), seguito da un 37% di omologia condivisa con geni batterici (McFall-Ngai et al., 2013), sebbene non sia ancora chiaro se la maggior parte di questi geni batterici siano stati trasferiti ai genomi animali dall'TGL, o se abbiano avuto origine all'inizio dell'evoluzione degli eucarioti (Domazet-loso e Tautz, 2008).
Il TGL inter-microbico è comune ed è particolarmente famoso per il ruolo che gioca nella diffusione rapida della resistenza antimicrobica. Ma può anche servire come risposta relativamente veloce nei confronti di un cambiamento nell'ambiente intestinale, come accade durante un infiammazione intestinale (Stecher et al., 2012). Rispetto al trasferimento fra batteri, il TGL è meno comune tra animali ospiti e microbi (Blaxter, 2007). Ciò è dovuto soprattutto al fatto che il TGL deve avvenire, perlomeno negli animali a riproduzione sessuata, nelle cellule germinali per essere trasmesso alla generazione successiva ed essere poi stabilizzato nella popolazione (Robinson et al., 2013). Tuttavia, questi eventi vengono riconosciuti sempre più di frequente, specialmente negli invertebrati (Boto 2012), alcuni dei quali sono strettamente associati con l'endosimbionte batterico linea germinale-trasmesso Wolbachia (Dunning Hotopp et al., 2007). Modificando un DNA di un organismo, il TGL fornisce una fonte di variabilità genetica selezionabile addizionale lungo il tempo, oltre alle mutazioni per coppie di basi, alle ricombinazioni, alle inserzioni, alle delezioni, ecc, e potrebbe quindi agire come un guida efficace di co-evoluzione, specialmente su scale di tempo evolutive più lunghe.
Inizialmente il termine “epigenetica” veniva usato per descrivere la programmazione dello sviluppo (Waddington, 1953), e solo in seguito è stata definita in riferimento ai cambiamenti ereditabili nell'espressione genica che non hanno origine da mutazioni della sequenza del DNA (Holliday, 1987). In tempi più recenti, la definizione del termine viene frequentemente discussa e in maniera controversa (come indicato nella citazione iniziale, tratta da Ledford, 2008; Ptashne, 2013a, b) ed è spesso usato in senso più ampio, con specifiche connotazioni a seconda del campo di studio. In opposizione alla precedente definizione rigorosa, alcuni ricercatori si concentrano sull'aspetto dell'ereditarietà di un tratto fenotipico di tipo germinale transgenerazionale e sequenza-indipendente, sopratutto neuroscienziati e psichiatri biologici, i quali evidenziano l'impatto delle esperienze postnatali sullo sviluppo e sul comportamento durante la vita adulta (per esempio, Meaney e Szyf, 2005). Eppure un altro ramo della biologia dello sviluppo interpreta i tratti epigenetici transgenerazionali nel contesto della differenziazione cellulare durante la crescita multicellulare dell'organiso (mitosi somatica; Müller e Leutz, 2001; Steffen e Ringrose, 2014). La maggior parte di queste definizioni hanno in comune l'uno o l'altro aspetto della memoria (trascrizionale), nel senso che l'effetto di uno stimolo si perpetua anche se il segnale o evento iniziale scompare (Ptashne, 2007). Ispirata da un apparente sovrapposizione di questo input con i ricordi del cervello, la definizione di epigenetica in neurobiologia molecolare è spesso usata in maniera piuttosto generica per indicare una serie comune di segnalazioni molecolari a cascata, che influenzano la regolazione dinamica dell'espressione genica dovuta ad una attività neuronale, chiamata anche neuroepigenetica o plasticità della cromatina (Dulac, 2010; Sweatt, 2013; Fischer, 2014A).
Alcuni studi recenti hanno indicato l'affascinante possibilità che l'esperienza di vita e altri traumi ambientali acquisiti nella generazione dei genitori possano risolversi in una funzione alterata del cervello e in cambiamenti comportamentali nelle generazioni successive (Weaver et al, 2004;. Arai et al, 2009;. Franklin et al, 2010;.. Bohacek et al, 2013; Dias e Ressler, 2014;. Gapp et al, 2014). Mentre solo poche indagini hanno dimostrato che le influenze di sostegno, come ad esempio il miglioramento della memoria attraverso l'arricchimento ambientale (Arai et al., 2009), o l'elusione di un odore potenzialmente nocivo (Dias e Ressler, 2014), possono essere tramandate alla generazione successiva, questa ereditarietà epigenetica transgenerazionale è tuttavia meglio documentata per gli eventi decisamente stressanti come l'esposizione al trauma. Questo tendenza può essere spiegata con la maggiore accessibilità ai modelli sperimentali che inducono robusti e funzionali cambiamenti epigenetici con conseguenze negative, quali l'aumento depressivo o comportamenti simili all'ansia, e a situazioni ambientali basate sullo stimolo della fame. Inoltre, l'ereditarietà epigenetica transgenerazionale potrebbe essersi evoluta per offrire una prole dotata di una protezione contro mutamenti rapidi e avversi nell'ambiente della generazione precedente, e servire come mezzo per adattarsi rapidamente alle attuali situazioni ambientali. Può quindi essere interpretata come una serie di meccanismi che offrono “scorciatoie” evolutive per aggirare il lungo processo di selezione naturale necessario ad imprimere informazioni ambientali nella sequenza di DNA del genoma, e per essere in grado di rispondere agli imprevedibili e rapidi cambiamenti nell'ambiente che possono avvenire entro l'arco di una generazione. È interessante notare, che in modelli sperimentali, gli effetti comportamentali di questi adattamenti epigenetici svaniscono rapidamente se non vengono rinforzati, il che evidenzia la loro plasticità e reversibilità. Questo impermanenza denota anche la scarsa necessità che alcuni tratti epigenetici siano stabilizzati in una popolazione e diventino parte di meccanismi mendelini innati dell'ereditarietà, dal momento che i fattori ambientali che conducono a questi tratti sono dinamici e imprevedibili.
Tuttavia, se gli effetti di esperienze traumatiche o stressanti possono essere ereditati per preparare e proteggere la prole da un ambiente nocivo, questi sollevano la questione se il fenotipo comportamentale osservato in modelli sperimentali, inclusi comportamenti di tipo depressivo e ansiogeno, sia in realtà protettivo. Se questi cambiamenti non sono soltanto sottoprodotti pleiotropici del macchinario epigenetico regolatore dell'espressione genica nel genitore, allora ci deve essere un effetto benefico nel tramandarli alla generazione successiva e i comportamenti espressi dalla prole potrebbero essere effettivamente protettivi. Mentre abbiamo pochi dubbi ad accettare che le informazioni utili relative alle condizioni attuali vengano (epigeneticamente) trasmesse alla generazione successiva, c'è qualche difficoltà nel comprendere il vantaggio che si ha quando le condizioni avverse innescano effetti negativi, come ad esempio un aumento del rischio di disturbi psichiatrici nelle generazioni successive. Comunque sia, potrebbero esserci degli scenari in cui risulta vantaggioso ereditare informazioni sulle sfide ambientali che hanno influenzato negativamente la generazione dei genitori e continueranno a incidere sulla prole.
Una tale posizione suggerisce prima di tutto che gli effetti negativi, come le risposte fisiologiche e comportamentali di stress che si osservano in apparati sperimentali, non sono negativi. Di conseguenza, l'aumento della reattività allo stress, la diminuzione della resilienza, o il comportamento di tipo depressivo, potrebbero in realtà essere tratti protettivi relativi alle condizioni vissute dalla generazione precedente. Questo ragionamento è in accordo con l'interpretazione della risposta allo stress fisiologico, che Hans Selye sostenne quando pubblicò per primo la teoria dello stress (Selye, 1978; Dubrovsky, 2002), e che fu poi riutilizzata da Munck et al. (1984) a sottolineare la funzione protettiva degli elevati livelli di glucocorticoidi in risposta allo stress. Curiosamente questa interpretazione offre anche una spiegazione dell'apparente “paradosso del corticosterone” osservata in topi privi di germi. Mentre i livelli di corticosterone sono generalmente più alti in questi topi rispetto alla linea basale e ancora più esagerati in condizioni di stress, tuttavia il loro comportamento mostra in realtà un ridotta presenza di ansia. Di conseguenza, i ricercatori di psichiatria evolutiva quali Nesse (2000) o Stevens e Price (2000) si sono schierati a favore dell'ipotesi per cui la depressione e altre patologie psichiatriche potrebbero essere in realtà adattamenti evolutivi con un loro incremento netto nel fitness umano. Comunque, quest'ultima ipotesi è stata fortemente criticata per quanto riguarda l'interpretazione dei meccanismi evolutivi (Dubrovsky, 2002; McLoughlin, 2002) e per la loro rilevanza nella pratica clinica.
In alternativa, l'ereditarietà epigenetica di eventi stressanti potrebbe essere pleiotropica, ossia è l'effetto collaterale negativo di meccanismi altrimenti benefici, che forniscono flessibilità e versatilità in risposta alle sfide ambientali e di solito conferiscono un vantaggio netto complessivo. In maniera simile, ricercatori come Corvo e Baron-Cohen sostengono il ruolo degli effetti pleiotropici nei disturbi mentali, con Crow pronto a suggerire che la schizofrenia e la psicosi possano essere schemi atipici della lateralizzazione dell'emisfero cerebrale e quindi un effetto collaterale della variazione genetica che fu necessaria per l'evoluzione del linguaggio umano (Crow 1995, 1997) e con Baron-Cohen che propone una teoria di autismo che spiega gli ASDs come effetti avversi dello sviluppo della funzione cognitiva superiore (“sistematizzare”) a spese delle funzioni di sostegno all'empatia (“empatizzazione”) ( Baron-Cohen, 2009). Si è tentati di speculare se anche gli effetti collaterali negativi dell'ereditarietà epigenetica sono coinvolti in queste condizioni.
Anche se è difficile verificare empiricamente se uno o entrambi questi scenari sono realmente alla base del crescente rischio di tali disturbi, questi eventi probabilmente riflettono i costi di mantenimento di un sistema di ereditarietà epigenetica benefico che a volte può andare storto.
Il Macchinario Epigenetico Molecolare: Un'Interfaccia per le Interazioni Microbo-Cervello nell'Evoluzione e nello Sviluppo
“QUESTE IDEE POSSONO AVERE CONSEGUENZE PROFONDE QUANDO INIZI A PARLARE DI COME LA STRUTTURA SOCIALE POSSA INFLUENZARE LO SVILUPPO COGNITIVO. STIAMO COMINCIANDO A TRATTEGGIARE LE DIRETTRICI DI CAUSA ED EFFETTO TRA LE MACROVARIABILI SOCIALI ED ECONOMICHE, FINO A GIUNGERE AL PIANO CHE INTERESSA IL CERVELLO DEL BAMBINO”
(Michael Meaney, 2006)
Il Ruolo della Plasticità della Cromatina e degli RNA Non-Codificanti nella Funzione Neuronale e nello Sviluppo
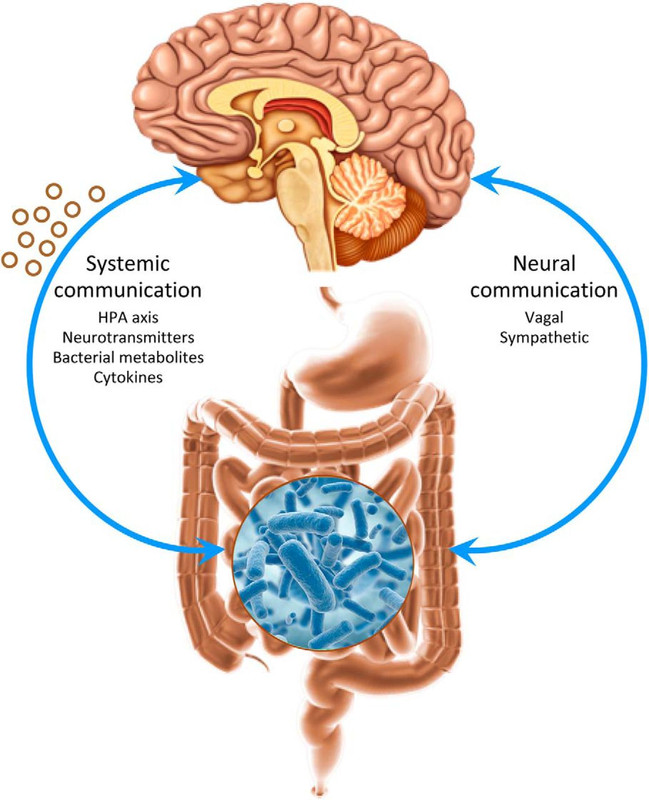
Il microbiota intestinale produce molti composti neuroattivi che possono influenzare direttamente il modo in cui i neuroni comunicano fra loro. Tali composti sono, ad esempio, gli amminoacidi, (es. il GABA e il triptofano), nonché le monoamine, quali la serotonina, l'istamina e la dopamina, usate come neurotrasmettitori nel cervello o come loro precursori (Lyte e Freestone, 2010; Lyte, 2011; Thomas et al, 2012a;.. parete et al, 2014). Nei topi privi di germi, la dopamina e l'espressione del recettore del glutammato (Sudo et al, 2004;. Heijtz et al, 2011;.. Neufeld et al, 2011) come pure il metabolismo del triptofano e i livelli di serotonina, sono significativamente alterati nella circolazione ma anche nel cervello durante lo sviluppo (Clarke et al., 2013), suggerendo che i neurotrasmettitori e i loro precursori potrebbero essere alcuni dei segnali messi a disposizione dal microbiota per stabilire l'asse intestino-cervello come un importante regolatore del neurosviluppo. Tuttavia, vi è un accumularsi di prove per le quali anche i meccanismi epigenetici molecolari sono coinvolti nel plasmare la formazione e il funzionamento del cervello e che possono essere influenzati dai simbionti microbici.
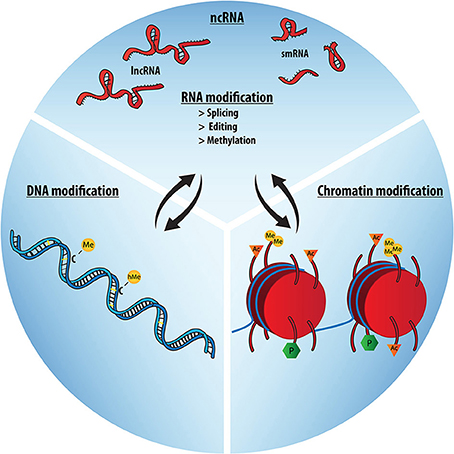
La questione di quali molecole e di quali meccanismi molecolari compongano il macchinario epigenetico è parallela al dibattito sulla sua definizione. Anche se la prova finale riguardo la causa o la conseguenza della regolazione genica è insufficente, la maggior parte della letteratura ora considera principalmente tre meccanismi nel comporre il macchinario epigenetico molecolare, che mediano i cambiamenti plastici nella regolazione dell'architettura nucleare, nella struttura cromatinica e nell'espressione genica. Vale a dire, questi sono modificazioni degli istoni, quali l'acetilazione o la metilazione, modificazioni del DNA come la CpG-metilazione o la CpG-idrossimetilazione, e infine modifiche degli RNA regolatori (Figura 3). Questi regolatori chiave dell'espressione genica integrano i segnali ambientali e altri stimoli a livello trascrizionale o traduzionale, e possono così portare alla commutazione del quantitativo espressivo di un gene, il che è un fattore importante che rivela l'effetto dei polimorfismi sull'ambiente attuale. Questo rende i meccanismi epigenetici importanti mediatori delle interazioni fra gene e ambiente e fra genoma e microbioma.
www.frontiersin.org/files/Articles/11000...mb-04-00147-g003.jpg
È importante sottolineare che tutti questi processi hanno anche mostrato di giocare un ruolo importante nella funzione cognitiva durante la salute e la malattia (articoli recenti in merito sono Day e Sweatt, 2011; Kosik et al, 2012;. Fischer, 2014a; Woldemichael et al 2014. ). Come tali, il consolidamento della memoria a lungo termine e la plasticità sinaptica dipendono molto dalla regolazione dinamica dell'espressione genica nell'ippocampo (Igaz et al, 2002, 2004;.. Da Silva et al, 2008) e i ruoli e le interazioni di tutti e tre i meccanismi del macchinario epigenetico sono stati identificati. L'acetilazione degli istoni è meglio conosciuta per il ruolo coadiuvante nella regolazione genica per apprendimento-indotto. Gli enzimi catalizzanti (istoni acetiltransferasi, HATs e istoni deacetilasi, HDACs) sono ben studiati e possono essere mirati farmacologicamente, il che li rende bersagli promettenti per il trattamento delle malattie neurodegenerative e di declino cognitivo (Stilling e Fischer, 2011; Gräff e Tsai, 2013; Fischer, 2014b). Il meccanismo d'azione di questi trattamenti presumibilmente implica il potenziamento della risposta intrinseca del neurone verso l'attivazione o la facilitazione del normale programma regolativo, nelle circostanze in cui ha perduto il suo equilibrio (Peleg et al, 2010;. McQuown e Legno, 2011; Stilling e Fischer 2011).
Più di recente, anche la plasticità basata sull'RNA sta iniziando ad emergere come regolatrice decisiva della funzione neuronale, dello sviluppo del cervello, della cognizione e della malattia psichiatrica (Barry e Mattick, 2012; Qureshi e Mehler, 2012). Queste comprendono piccoli RNA, come miRNAs (O'Connor et al, 2012;. Saab e Mansuy, 2014) e piRNAs (Landry et al 2013) ma anche lncRNAs (Ng et al, 2013;. Schaukowitch e Kim, 2014), oltre all'RNA editing, che influenza principalmente gli mRNAs espressi nel cervello e li ha drammaticamente aumentati negli esseri umani rispetto ad altre specie, e lo splicing alternativo stimolo-dipendente (Schor et al., 2009, 2013). Anche l'mRNA metilazione è stata recentemente segnalata per essere ricca nel tessuto cerebrale ed essere notevolmente aumentata nel cervello adulto (Meyer et al., 2012). È importante notare che molti di questi processi basati sull'RNA non solo interagiscono fra di loro (Barry e Mattick, 2012), ma sono anche intimamente legati ad altre controparti del macchinario epigenetico (Figura 3). Ad esempio, gli lncRNAs possono agire da molecole guida sequenza-specifica per gli enzimi istone-modificanti, come gli istoni metiltransferasi (Sanchez-Elsner et al, 2006;. Rinn et al., 2007), e le modificazioni della cromatina contribuiscono a determinare la scelta del sito di splicing ( Luco et al, 2011;.. Kornblihtt et al, 2013), per citarne solo alcuni.
Come può il Microbiota Agire nello Sviluppo e sul Comportamento Tramite Meccanismi Epigenetici?
L'idea che meccanismi epigenetici possano essere dei mediatori chiave nelle interazioni tra ospiti e microrganismi patogeni o parassitari, è già stata proposta precedentemente (Minárovits, 2009; Paschos e Allday, 2010; Al Akeel, 2013; Silmon de Monerri e Kim, 2014; Stilling et al. , 2014). Tuttavia, è chiaro che simili costrutti valgono per l'interazione tra ospite e microbiota non-patogeno (Shenderov, 2012; Shenderov e Midtvedt, 2014) e che quest'ultimo potrebbe avere forti implicazioni per la regolazione dell' evoluzione del cervello. Prima di tutto, è allora importante elencare alcuni dei potenziali attori in questo contesto.
Acidi grassi a catena corta
Oltre a sintetizzare neurotrasmettitori o precursori, la flora intestinale produce altre sostanze chimiche con un potenziale di neuro-modulazione. In quanto tale, la fermentazione di fibra da batteri intestinali è la prima fonte di acidi grassi a catena corta (SCFAs) come l'acido butirrico, l'acido propionico e l'acido acetico. Gli SCFAs non sono di per sé sostanze neuroattive, ma potrebbero agire sulla funzione neuronale in maniera più sottile. Ad esempio, il butirrato è meglio conosciuto per la sua potente inibizione degli HDACs (Candido et al, 1978;. Davie, 2003). Sebbene già altrove abbiamo riesaminato i dettagli delle interazioni degli SCFAs con la macchina epigenetica (Stilling et al., 2014), vi è ora una nuova e solida prova che i microbi hanno un impatto significativo sulla regolazione epigenetica nell'epitelio intestinale dell'ospite e sul sistema immunitario. Gli effetti sono stati riportati per essere principalmente mediati dal butirrato e correlati all'attività alterata dell'HDAC (Alenghat et al, 2013;. Arpaia et al, 2013;. Furusawa et al, 2013;. Smith et al, 2013;.. Chang et al, 2014).
Inoltre, l'acido acetico influenzerà la disponibilità di substrato HAT (Acetil-Coenzima A) e quindi porterà a livelli più elevati l'istone-acetilazione dinamica nei neuroni, che potrebbero venire compromessi quando il microbiota normale è disturbato o del tutto assente. Entrambi i meccanismi porteranno ad un aumento di acetilazione degli istoni, il quale va a facilitare il consolidamento della memoria, la neurogenesi e la neuroprotezione (Fischer et al, 2007, 2010;.. Kilgore et al, 2010; Peleg et al, 2010;.. Govindarajan et al, 2011). In particolare, infusioni intracerebroventricolari di acido propionico hanno dimostrato di indurre nei ratti comportamenti di tipo autistico (MacFabe et al, 2011;.. Thomas et al, 2012b), suggerendo che gli SCFAs sono anche implicati nella modulazione dei comportamenti sociali. Anche se gli effetti di SCFAs che attraversano la barriera emato-encefalica in condizioni normali potrebbero essere marginali, una persistente secrezione di SCFAs da parte della flora intestinale potrebbe provocare effetti cumulativi di lunga durata sugli schemi di espressione genica, che sono necessari per un adeguato sviluppo e funzione neuronale.
In conclusione, gli SCFAs microbici sono collaboratori importanti per il metabolismo dell'ospite e pertanto hanno una ruolo chiave nell'azione olometabolica, o come fonte di energia, o attraverso il bilanciamento dell'espressione genica ospite durante lo sviluppo del cervello e, in modo più dinamico, in età adulta (Selkrig et al., 2014).
Mimetismo microbico del macchinario epigenetico dell'ospite
Oggi, è ben documentato il fatto che i microbi possono prendere direttamente di mira il macchinario regolativo trascrizionale dell'ospite. Soprattutto i virus sono noti per sfruttare le cellule infette a proprio vantaggio, e ciò non ci coglie di sorpresa, dato che dipendono notevolmente sul macchinario molecolare del loro ospite per la replicazione e la propagazione. In quanto tali, determinati virus influenzali utilizzano il macchinario epigenetico dell'ospite per stimolare la propria replicazione o per nascondersi all'interno delle regioni silenti del genoma degli ospiti (Minárovits, 2009). Un altro meccanismo per eludere la risposta antivirale della cellula ospite utilizza la proteina NS1 istone-mimetica virus-codificata, che media la repressione trascrizionale (Marazzi et al., 2012). Anche diversi batteri possono nascondere proteine che imitano dei componenti del macchinario epigenetico ospite (Bhavsar et al, 2007;. Murata et al, 2007;. Hamon e Cossart, 2008; Pennini et al, 2010;. Bierne e Cossart, 2012; Bierne et al, 2012;. Rennoll-Bankert e Dumler, 2012; Bierne, 2013;. Eskandarian et al, 2013;. Rolando et al, 2013). Comunque, finora tali effettori sono stati trovati esclusivamente in parassiti intracellulari come la Legionella pneumophila, i quali hanno un contatto diretto con l'ambiente intracellulare nel modulare la trascrizione della cellula-ospite. In più, meccanismi basati dull'RNA miranti alla regolazione trascrizionale dell'ospite, sono stati aggiunti alla crescente lista degli effetti microbici sulla trascrizione ospite (Liu et al., 2012). Questo studio ha scoperto chw E. coli è capace di produrre piccoli RNA non-codificanti che agiscono, in modo simile ai piccoli RNA interferenti (siRNAs), su alcuni mRNAs dell'ospite. Questa interazione non dipende dalla localizzazione intracellulare del simbionte, così resta poco chiara la maniera con la quale gli RNA non-codificanti dell'E. coli possano coprire la distanza tra le specie, per interferire poi con l'mRNA del C. elegans.
Gran parte della ricerca in merito si è concentrata sui parassiti, ossia, virus e batteri patogeni (Minárovits 2009; Paschos e allday, 2010; Alakeel, 2013; Silmon de Monerri e Kim 2014), e lascia aperta l'intrigante questione, se gli agenti patogeni nel cervello abbiano i mezzi per alterare la trascrizione nei neuroni, i quali a loro volta potrebbero avere un effetto sul comportamento dell'ospite. Recentemente questa previsione sembra essersi realizzata nella scoperta che l'infezione da Toxoplasma gondii si risolve nell'ipometilazione del DNA sul promotore del gene dell'arginin-vasopressina (Avp), e quindi nell'aumentata espressione di questo gene nell'amigdala di ratti infetti, la quale era sufficiente per indurre una manipolazione comportamentale fenotipica (Hari Dass e Vyas, 2014). Inoltre, non è ancora chiaro se esistano meccanismi simili in qualsiasi microbo intestinale. Tuttavia, questi studi pionieristici dimostrano le varie strade che i microbi usano per interagire con epigenoma dell'ospite.
In conclusione, possiamo dire che ci sono vari possibili percorsi per i microbi d'interagire con la funzione cellulare dell'ospite e sul suo comportamento, e alcuni di questi potrebbero essere mediati da alterazioni della regolazione epigenetica nel cervello.
Relazioni Confuse - Chi è il Burattino, chi è il Burattinaio?
“SFORTUNATAMENTE, NELLA VITA DEI BURATTINI C'È SEMPRE UN MA CHE ROVINA OGNI COSA.”
(Carlo Collodi, 1883, "Le avventure di Pinocchio")
Dei 5 modi canonici con cui specie diverse possono interagire tra di loro (mutualismo, commensalismo, rivalità, predazione e parassitismo), il parassitismo alla lunga sembrava avere il maggiore impatto sull'accelerazione dell'evoluzione. Questa è stato riconosciuto dalla cosiddetta “Ipotesi della Regina Rossa”, un concetto utilizzato per descrivere una rapida co-evoluzione ospite-parassita, e parafrasato da un personaggio del romanzo di Lewis Carroll: Alice nel paese delle meraviglie. Altre forme di simbiosi, soprattutto il mutualismo, sono state trascurate a questo proposito, sebbene ora stanno emergendo per essere altrettanto importanti (Ezenwa et al., 2012).
Comunque, in molti casi risulta arduo determinare dove un dato microorganismo sia collocato in quello che appare essere uno spettro che va dal mutualismo al parassitismo, o a meno che, la traiettoria co-evolutiva resta ancora non del tutto conosciuta. In più, i cambiamenti nell'ambiente potrebbero modificare la natura dell'associazione. Ad esempio, è stato ipotizzato che il Mycobacterium tuberculosis, un agente patogeno oggi ben noto, possa aver contribuito all'evoluzione umana come un simbionte benefico, fornendo una fonte di nicotinamide essenziale durante carenze di carne (Williams e Dunbar, 2014). Un ulteriore prova di una stretta dipendenza dalle condizioni ambientali determinante il modo in cui un particolare microrganismo è associato con l'ospite, viene da un recente studio sul Helicobacter pylori, che sembra mostrare una virulenza significativamente differente fra due popolazioni umane indipendenti (Kodaman et al., 2014). Allora, una linea temporale causale di simbiosi è difficile da ricostruire in maniera retrospettiva, e anche ciò che appare oggi come mutualismo obbligato, potrebbe non essere iniziato come qualcosa di reciprocamente vantaggioso.
La classificazione delle interazioni ospite-microbo è ulteriormente complicata dalla necessità di definire benefici e svantaggi per entrambi i lati. Come tale, essa è altamente discutibile se il commensalismo stretto esiste veramente. Anche nelle relazioni mutualistiche molti casi potrebbero non essere chiari. In un tale relazione, entrambe le specie beneficiano reciprocamente l'una dall'altra. Ad esempio, mentre la flora intestinale trae vantaggio da un costante apporto di sostanze nutritive e da una temperatura ambientale relativamente elevata, se permette un ricambio metabolico veloce, l'ospite beneficia di una maggiore disponibilità di nutrienti attraverso un'attività enzimatica che non viene codificata nel suo genoma (ad esempio, la digestione di fibra). Ma, dal momento che i vantaggi di questa relazione, potrebbero aver compensato possibili svantaggi durante l'evoluzione, gli effetti collaterali negativi dell'associazione potrebbero oggi venire ignorati o non riconosciuti come dannosi, se visti in maniera retrospetiva.
A questo proposito, una domanda eccitante per quanto riguarda l'evoluzione del comportamento sociale è: Chi è il burattino e chi è il burattinaio nella trasmissione sociale di microbi? Da un lato, i microbi che sviluppano mezzi di trasmissione più veloci e frequenti saranno selezionati positivamente. Questo potrebbe includere meccanismi co-evolutivi e input di sviluppo, come si è descritto in questo articolo, che portano ad un aumento della socialità di una popolazione, o di una specie, o addirittura alla diretta manipolazione comportamentale del singolo ospite. Questo si collega ulteriormente alla questione: Che cosa c'è all'interno dell'ospite per il microbiota? Perché fornisce spunti per lo sviluppo, perché ne influenza il comportamento? Un recente tentativo di rispondere ad alcune di queste domande è stato avanzato, sostenendo che il comportamento alimentare dell'ospite possa essere manipolato da specifici interessi, di particolari microbi, che risiedono nell'intestino (Alcock et al., 2014). Un altra semplice ma provocatoria spiegazione, derivante da dati discussi in questo articolo, è che i batteri promuovono comportamenti sociali nei mammiferi e la vita di gruppo per diffondesi più facilmente a nuovi ospiti e così riprodursi in modo più efficiente.
Infatti, esempi affascinanti di interazione ospite-microbo si trovano in parassiti che sono noti per manipolare il comportamento dell'ospite al fine di riprodursi e diffondersi. I ricercatori hanno trovato una crescente varietà di parassiti in tutti i domini della vita, che dipendono dalla modificazione del comportamento dell'ospite per il completamento del loro complesso ciclo di vita. Questi includono i membri provenienti da una vasta gamma di phyla, come la piccola fascicola epatica Dicrocoelium dendriticum, il fungo delle formiche-zombie Ophiocordyceps unilateralis, o il verme gordiano Paragordius tricuspidatus , oltre a quelli più comuni, come il virus della rabbia, che induce nei mammiferi aggressività e paura dell'acqua, o il protozoo ubiquitario Toxoplasma gondii, meglio conosciuto per indurre nei roditori l'attrazione per l'odore di urina del gatto, ma è anche implicato nella schizofrenia (Berdoy et al, 2000;. Webster, 2001; Vyas et al, 2007;. Libersat et al, 2009;. Cézilly et al, 2010;.. Thomas et al, 2010; Flégr, 2013; Webster et al, 2013;. per ulteriori approfondimenti vedi il numero speciale sulla parassitologia neurale nel numero di gennaio 2013 del Journal of Experimental Biology). È interessante notare che i meccanismi neurologici alla base di questi casi devono ancora essere scoperti nel dettaglio. Dato il contatto molto intimo con i processi neuronali intracellulari, è intrigante ipotizzare che l'alterazione comportamentale dell'ospite potrebbe essere ottenuta manipolando il macchinario di trascrizione dei neuroni ospiti.
Comunque, risulta molto meno spettacolare la risposta al perché un microbiota normale, sano, e abbastanza non-parassitico possa fornire imput di sviluppo che facilitano il comportamento sociale. Il problema è che si tende a pensare a tale questione entro un quadro teleologico, e di imporre delle intenzionalità ai batteri stessi. Da questa prospettiva, tale problema si riduce ad una domanda mal posta, e probabilmente non c'è risposta soddisfacente ad essa, perché il microbioma è diventato solo una parte dei corpi multicellulari, sebbene questi hanno formato e ora condividono una lunga storia di co-evoluzione insieme. Data questa stretta associazione, non possiamo imporre in maniera semplicistica intenzionalità opposte al microbiota e all'ospite, dal momento che non avremmo fatto questo nei confronti delle cellule originarie del tessuto-ospite.
Conclusioni e prospettive future
Il Microbiota come "Episimbionte" all'interno di un Olobionte
“L'INTERA EVOLUZIONE E' CO-EVOLUZIONE”
(Stuart Kauffman, 1995)
In questo articolo, presentiamo i possibili meccanismi delle interazioni ospite-microbo che avvengono attraverso i processi epigenetici molecolari, e offriamo gli argomenti per suggerire che le alterazioni del microbioma e le modifiche epigenetiche, come pure la regolazione basata sull'RNA dell'espressione genica, sono collegate nel plasmare l'evoluzione del cervello e lo sviluppo neurologico. Oltre a presentare le prove dell'influenza piuttosto diretta sui sistemi neuroendocrini e neurotrasmettitori, abbiamo ulteriormente suggerito che alcuni prodotti microbici possano modulare il panorama epigenetico del cervello ospite. Queste possibilità includono regolatori dell'attività degli enzimi istone-modificanti, sia attraverso alterazioni metaboliche, sia tramite interazioni dirette tra le molecole secrete dai batteri (come SCFAs) e le vie di segnalazione dell'ospite. Insieme, questi meccanismi forniscono importanti input con ritmi critici, per il neurosviluppo ospite, e quindi continuano ad influenzare il comportamento sociale in maniera co-evolutiva e di co-sviluppo. Al momento, non è chiaro se alcuni dei fenotipi comportamentali che sono associati con l'alterata colonizzazione microbica, compresi i modelli per gli ASDs, siano dovuti alla minore disponibilità di SCFAs e/o di altri metaboliti con la funzione di modificazione epigenetica. Evidentemente, alcuni parassiti sono in grado di dirottare il macchinario epigenetico della cellula-ospite e questo potrebbe rendere utile la ricerca di analoghi effettori in batteri simbionti o commensali, per valutare un traducibile potenziale terapeutico di tali meccanismi.
Inoltre, sosteniamo che il microbiota è un'interfaccia essenziale per le interazioni gene-ambiente. Queste interazioni potrebbero trovarsi al centro di combinazioni genotipo-enterotipo incompatibili e presumibilmente avere un peso fondamentale per lo studio dei fattori di rischio genetici malattia-associati con una funzione non ancora rilevata. Tali incompatibilità avranno anche implicazioni per lo screening del donatore nelle terapie di trapianto fecale.
Con queste funzioni in mente, facciamo notare che il microbiota condivide con l'ospite anche alcune caratteristiche importanti nell'ambito della loro interazione, paragonabili ai meccanismi epigenetici classici come la modificazioni degli istoni, la metilazione del DNA e la regolazione mediata dall'ncRNA. Queste caratteristiche includono (1) la trasmissione verticale (ereditarietà transgenerazionale) di microbi (acquisiti), (2) la risposta agli stimoli ambientali e la facilitazione delle interazioni gene-ambiente, (3) la determinazione dei programmi di espressione genica e la regolazione dello sviluppo, e (4) la reversibilità.
Quindi, è interessante guardare i meccanismi epigenetici canonici come mediatori di segnali di sviluppo inviati dal microbiota, oltre che considerare anche i simbionti stessi come entità epigenetiche, come noi ed altri abbiamo già sostenuto (Gilbert et al, 2010;. Fitzpatrick 2014; Stasi e Toccaceli, 2014;. Stilling et al, 2014). Comunque, il microbioma è chiaramente più complesso e dinamico di un segnale epigenetico, in quanto i simbionti hanno propri genomi capaci di rispondere all'adattamento, laddove una modificazione epigenetica molecolare non è di per sé soggetta alla selezione naturale. Tuttavia, mentre l'analogia non potrebbe essere perfetta nel dettaglio, questa prospettiva diventa utile per capire come il microbioma rappresenti un'ulteriore interfaccia per le influenze ambientali, e una fonte dinamica di regolazione dello sviluppo transgenerazionale. Oltre tutto, pone il microbiota in linea con altri meccanismi che accelerano l'adattamento ambientale a breve termine e potrebbe essere particolarmente utile per unificare diverse teorie di co-evoluzione ospite-microbo e l'evoluzione del “cervello sociale”. Di fatto, questo punto di vista potrebbe contenere alcune risposte alle domande fondamentali nei campi dell'epigenetica e della neuroepigenetica (Bohacek et al, 2013;. Sweatt, 2013). La composizione microbica ospite-specifica potrebbe essere considerata come parte delle “impressioni parentali” che sono state suggerite per preparare la prole ad un ambiente imprevedibile (Cameron et al, 2008;. Badyaev e Muller, 2009). Un accurato progetto sperimentale, che possa includere gli studi di affidamento incrociato (cross-fostering) e quelli di fecondazione in vitro, affiancati da studi di evoluzione sperimentale longitudinale, si rende necessario per capire quanto a lungo gli effetti transgenerazionali possano persistere, e per definire le comunicazioni bidirezionali cervello-intestino-microbo, come parte di un paradigma basato su un' “ereditarietà sottile”(Sweatt, 2013).
L'Armonizzazione della Teoria Ologenomica e del Lamarckismo Apparente con la Prospettiva Neo-Darwiniana
“TUTTE LE ACQUISIZIONI O TUTTE LE PERDITE FORGIATE DALLA NATURA SUGLI INDIVIDUI, TRAMITE L'AMBIENTE NEL QUALE LA LORO RAZZA E' STATA A LUNGO COLLOCATA, [...] OGNUNA VIENE PRESERVATA CON LA RIPRODUZIONE NEI NUOVI INDIVIDUI CHE VENGONO A PRESENTARSI (...)”
(Jean-Baptiste Lamarck, 1809)
Questa citazione riassume la seconda legge della teoria lamarckiana dell'evoluzione, che ha cercato di spiegare il cambiamento evolutivo, tramite l'ereditarietà delle caratteristiche acquisite durante la vita di un individuo. Recenti scoperte sperimentali, come quelle trattate in questo articolo, così come l'interesse generale verso la trasmissione epigenetica della variazione fenotipica, hanno ripetutamente sollecitato gli autori a resuscitare parzialmente questa teoria, o almeno sollevare la questione della misura in cui questi aspetti lamarckiani contribuiscano all'adattamento in una maniera complementare alla teoria di Darwin e Wallace sull'evoluzione (o, più precisamente, la moderna sintesi di genetica ed evoluzione), (ad esempio, Smythies et al, 2014;. Szyf, 2014). Tuttavia, riteniamo che questo modo d'intendere l'epigenetica è di scarsa utilità per due motivi principali. In primo luogo, l'informazione non-genetica è in ultima istanza, codificata da informazioni genetiche, ovvero, esistono geni per i processi epigenetici, come i geni che codificano gli enzimi istone-modificanti, o gli enzimi DNA-modificanti. Questi geni cromosomici sono chiaramente alla base dei modelli comunemente accettati di ereditarietà mendeliana, e saranno soggetti alla selezione naturale o all'evoluzione neutrale (deriva genetica) proprio come qualsiasi altro gene. In secondo luogo, mentre la capacità di passare informazioni ambientali alla generazione successiva rappresenta un'altra fonte di variabilità su cui la selezione naturale può agire, è inverosimile che il risultato di un'ereditarietà epigenetica venga stabilizzato e fissato lungo l'evoluzione. Presi assieme, questi argomenti implicano che sarà piuttosto la possibilità di ereditare epigeneticamente l'informazione ambientale in sé, cioè i geni che codificano lo specifico macchinario epigenetico, che è positivamente selezionata per promuovere la flessibilità. Abbiamo perciò qui sostenuto, che i meccanismi epigenetici dovrebbero essere visti come la risposta evolutiva all'imprevedibilità intrinseca della natura, piuttosto che comporre un modello alternativo di evoluzione. Questa forma di meta-adattamento o adattabilità, alla quale Mattick si è riferito come quell'“evoluzione che ha imparato ad apprendere” (Mattick, 2009), può essere definita come la capacità di un sistema genetico di produrre e mantenere una variazione e una regolazione epigenetica potenzialmente adattative. Questa definizione deriva per analogia dal concetto di evolvibilità, definito come “la capacità del sistema genetico di produrre e mantenere varianti genetiche potenzialmente adattative” (Hansen, 2006; Pigliucci, 2008).
Tale rivalutazione nasce dal fatto che gli animali vivono in un mondo popolato da batteri (McFall-Ngai et al., 2013), e non è ormai possibile vedere l'animale come separato dai microbi di cui necessita per sopravvivere, riprodursi, e per evolversi nel corso del tempo. Un principio che mette in luce questo tema è il concetto di ologenoma, il quale combina il genoma pluricellulare dell'ospite e il microbioma associato in un unità autonoma di selezione non escludente le altre unità di selezione (Booth, 2014; Rosenberg e Zilber-Rosenberg, 2014), e in più riconosce che alcune parti del genoma e del microbioma sono inseparabili nella codifica di un organismo vitale, e quindi soggetti a co-evoluzione in modi simili a quelli dei geni che si sono co-evoluti all'interno del genoma nucleare. Infatti, Fitzpatrick ha recentemente identificato le circostanze in cui questa premessa si compie, traendo uno schema matematico basato sulla comune genetica delle popolazioni, che fornisce un ulteriore supporto per l'inserimento dell'ereditarietà non-genetica (come i simbionti, le caratteristiche culturali e altri tratti epigenetici) nei concetti di evoluzione ( Fitzpatrick, 2014).
Al fine di armonizzare i diversi concetti di co-dipendenza ospite-microbo menzionati in questo articolo, tale principio potrebbe aiutarci ad assumere un punto di vista gene-centrico - e quindi a considerare i genomi dei simbionti, come dei cromosomi estesi dei genomi partecipanti all'interno di un olobionte. Da questo punto di vista, i geni che promuovono la simbiosi, modulando la loro controparte mutualistica, verrebbero selezionati positivamente, se questa a sua volta favorisce l'adattamento complessivo dell'olobionte. La parte eucariotica fornisce un veicolo autosufficiente per l'ologenoma, mentre i geni microbici contribuiscono integrando informazioni genetiche utili (e.s., le vie metaboliche), ma anche modulando lo sviluppo e l'evoluzione dell'olobionte in risposta agli stimoli ambientali.
Osservazioni finali
“NESSUNO E' IN SE' E PER SE' UNICO. […] L' “IO” E' INCATENATO ALLA STORIA DA UNA MOLTITUDINE DI CIRCOSTANZE […]. QUESTA NON E' UNA MERA ALLEGORIA, BENSI' UNA MEMORIA ETERNA”
(Erwin Schrödinger, 1918)
In questo articolo teorico, abbiamo raccolto argomenti per una visione integrata riguardo lo sviluppo del cervello e l'evoluzione, la simbiosi e la biologia dell'RNA, che insieme vanno a strutturare la condotta sociale (Figura 2). Il comportamento pro-sociale dipende da un corretto sviluppo del cervello, il che richiede un espressione genica temporizzata con precisione, e orchestrata da meccanismi regolatori epigenetici, come le modificazioni degli istoni, oltre all'ncRNAoma e altri meccanismi plastici basati sull'RNA (Figura 3). Data una potenziale co-evoluzione del comportamento sociale nei mammiferi e dei loro microbi, lo sviluppo del cervello è, oltretutto, particolarmente vulnerabile ai segnali microbici. Gilbert et al. ha suggerito che “abbiamo esternalizzato certi segnali di sviluppo” dal nostro microbiota (Gilbert et al., 2010). Comunque, dobbiamo considerare che l'evoluzione degli eucarioti probabilmente non ha mai visto un periodo senza la presenza di microbi, in modo che questi particolari segnali di sviluppo non sono mai stati prodotti “in casa”, ma sono il risultato di una co-evoluzione di ospite e microbiota. Gilbert e colleghi possono quindi approfittare della considerazione sull'evoluzione di Kauffmann nell'affermare che “quasi tutto lo sviluppo potrebbe essere co-sviluppo” (Gilbert et al., 2010). Infatti, assiema alla teoria di Lombardo dell' “accesso agli endosimbionti mutualistici” (Lombardo, 2008), questa prospettiva sul co-sviluppo tra cervello, intestino e microbiota può abbracciare un ulteriore anello mancante con l'“ipotesi del tessuto costoso” (Aiello e Wheeler 1995 ), poiché spiegherebbe come un microbiota socialmente trasmesso, vario e quindi altamente efficiente, potrebbe compensare la riduzione della dimensione del tratto gastrointestinale durante l'ampliamento del cervello dei primati, incrementando la disponibilità di nutrienti da una più ampia gamma di fonti.
Tale prospettiva risulta ora importante per determinare gli endosimbionti psicobiotici, vale a dire, i simbionti con un effetto benefico sulla salute mentale e sullo sviluppo neurologico (Dinan et al., 2013), che stabiliscono una relazione positiva durante lo sviluppo e che potrebbe essere un trattamento d'aiuto in caso di malattia. Capire il nostro rapporto a lungo termine con questi amici benefici avrà anche importanti implicazioni per la ricerca futura nel fornire raccomandazioni sullo stile di vita come la dieta, l'igiene e il comportamento in certi periodi critici della vita, fra cui la gravidanza e la prima educazione.
Non possiamo ancora comprendere appieno il potenziale epigenetico dei nostri amici batterici e quali siano i loro benefici sociali, nonostante ciò stiamo cominciando ad apprezzare la misura in cui le interazioni ospite-microbo guidano l'evoluzione e lo sviluppo del cervello.
Dichiarazione di Conflitto di Interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
Ringraziamenti
L'Alimentary Pharmabiotic Centre è un centro di ricerca finanziato dalla Science Foundation Ireland (SFI), attraverso il piano di sviluppo nazionale del governo irlandese. Roman M. Stilling è supportato dall'Irish Research Council (IRC) attraverso una borsa post-dottorato del governo irlandese. Seth R. Bordenstein è supportato dai premi di NIH (R01 GM085163) e NFS (DEB 1046149). Timothy G. Dinan e John F. Cryan sono supportati da SFI (la concessione è la n. 07 / CE / B1368 e 12 / RC / 2273). Timothy G. Dinan e John F. Cryan sono anche supportati dall'Irish Health Research Board, Health Research Awards (HRA_POR / 2011/23) e (HRA_POR / 2012/32).
"Now go consciously into the breath and let it go. Fully in, letting go, fully in, letting go." (Wim Hof)
χιλικάδο
Si prega Accesso a partecipare alla conversazione.
spectrumnews.org/opinion/viewpoint/guest...n-brain-development/
L'influenza dei batteri intestinali nello sviluppo del cervello
Di John F. Cryan, Roman Stilling / 4 Febbraio 2014
Il tentativo di comprendere come i fattori ambientali influenzano l'espressione genica, è oggi una delle aree più interessanti della biomedicina. Gli scienziati spesso etichettano questi effetti con il termine onnicomprensivo “epigenetica”.
Possiamo definire i fenomeni dell'epigenetica - modificazioni chimiche del DNA o delle sue proteine associate - come cambiamenti dinamici e potenzialmente ereditabili nell'espressione genica, che persistono anche dopo la scomparsa del segnale o dell'evento che ha avviato il cambiamento. Sempre di più, i ricercatori si stanno concentrando nel districare i meccanismi molecolari, presenti nel cervello in via di sviluppo e in quello adulto, alla base del cambiamento epigenetico.
In un articolo pubblicato nel numero di gennaio di Genes, Brain and Behavior, abbiamo sostenuto che i ricercatori considerano l'influenza del microbiota intestinale - la comunità di specie batteriche che vivono nel tratto digestivo - nella regolazione epigenetica delle funzioni cerebrali, soprattutto quando si studiano i disordini dello sviluppo neurologico come l'autismo (1).
Il toolkit epigenetico consiste tipicamente in modificazioni chimiche di proteine nucleari chiamate istoni, quali le singole basi del DNA e alcuni tipi di RNA non codificante. La circostanza per cui i fattori ambientali possono reversibilmente attivare o disattivare questi regolatori, rende questi ultimi interessanti bersagli terapeutici.
Ci sono crescenti prove di un legame tra l'autismo e le alterazioni nella diversità e nella ricchezza della microbioma intestinale (2). Questo non ci coglie di sorpresa, poiché fattori come l'infezione prenatale e complicazioni durante il parto - associati con un alterata colonizzazione microbica del bambino in via di sviluppo - sono stati implicati nell'autismo.
Il fatto che l'afflizione gastrointestinale sia un aspetto comune fra le persone con autismo supporta ulteriormente questa connessione (3). Topi privi di qualsiasi batterio intestinale mostrano deficit sociali e comportamenti ripetitivi simili a quelli osservati nelle persone con autismo (4).
Oltretutto, un ceppo specifico di batteri probiotici, somministrato solo tre volte dopo lo svezzamento, è in grado di invertire alcuni dei cambiamenti comportamentali osservati nei topi esposti alle infezioni in utero (5). Questa scoperta ha ulteriormente rinforzato il concetto di alterazione dell'asse microbiota-intestino-cervello nell'autismo.
I meccanismi epigenetici potrebbero svolgere un ruolo nello sviluppo dell'autismo (6), (7), ma al momento non è chiaro se questi sono in relazione alla composizione dei batteri intestinali. Nel nostro nuovo articolo, sosteniamo che le sostanze chimiche prodotte dai microbi intestinali possono influenzare la regolazione epigenetica nel cervello dell'ospite. Queste alterazioni possono a loro volta portare a mutamenti dell'espressione genica neuronale, che alla fine può alterare il comportamento dell'ospite.
A sostegno di questa ipotesi, la ricerca precedente ha mostrato che i batteri nei nostri corpi servono come fabbriche per la produzione di tutta una serie di composti neuroattivi, compresi neurotrasmettitori e acidi grassi a catena corta (
 ,(9). Alcuni di questi prodotti, come il butirrato, possono alterare la funzione degli enzimi che modificano le istone proteine e, quindi, cambiano l'espressione genica.
,(9). Alcuni di questi prodotti, come il butirrato, possono alterare la funzione degli enzimi che modificano le istone proteine e, quindi, cambiano l'espressione genica.Il microbiota intestinale è un importante regolatore del modo in cui i fattori genetici e ambientali convergono per alterare lo sviluppo del cervello. Perciò, dato che l'autismo è associato a entrambi i fattori di rischio, sia genetici che ambientali, i microbi intestinali sono allora pronti a giocare un ruolo chiave nella genesi di tale disturbo.
Poiché ogni essere umano ha un composizione genetica diversa, ma anche una propria impronta digitale individuale di specie microbiche, nota come “enterotipo”, ci aspettiamo che vi siano certi microbi che vivono preferenzialmente in persone con determinate varianti genetiche.
Infine - e forse in modo più provocatorio - proponiamo di considerare il microbiota in sé come un entità epigenetica autonoma.
Di conseguenza, questo significherebbe che il microbiota potrebbe contribuire ai cambiamenti ereditabili nell'espressione del fenotipo di una persona, o nelle sue caratteristiche osservabili. Noi sosteniamo che il microbiota può raggiungere questo obiettivo sfruttando meccanismi che sono simili a quelli del classico toolkit epigenetico.
Sebbene questo sia alquanto speculativo, l'applicazione di questi nuovi approcci alla ricerca dovrebbe migliorare la nostra comprensione dei processi che contribuiscono ai cambiamenti comportamentali nell'autismo e in altre malattie psichiatriche e dello sviluppo neurologico. Di conseguenza, le terapie a base di probiotici che influenzano il funzionamento del cervello, che abbiamo chiamato “psicobiotica”, potrebbero risultare capaci di dirigere tali meccanismi epigenetici (10).
John F. Cryan è professore di anatomia e neuroscienze e ricercatore capo nella Alimentary Pharmabiotic Centre presso l'University College Cork in Irlanda. Romano M. Stilling è un ricercatore post-dottorato presso il centro.
Fonti:
1: Stilling R.M. et al. Genes Brain Behav. 13, 69-86 (2014) PubMed
2: Mulle J.G. et al. Curr. Psychiatry Rep. 15, 337 (2013) PubMed
3: Buie T. et al. Pediatrics 125,S19-S29 (2010) PubMed
4: Desbonnet L. et al. Mol. Psychiatry 19, 146–148 (2014) PubMed
5: Hsiao E.Y. et al. Cell 155, 1451-1463 (2013) PubMed
6: Grafodatskaya D. et al. J. Am. Acad. Child Adolesc. Psychiatry 49, 794-809 (2010) PubMed
7: Miyake K. et al. Adv. Exp. Med. Biol. 724, 91-98 (2012) PubMed
8: Lyte M. PLoS Pathog. 9, Epub ahead of print (2013) PubMed
9: Cryan J.F. and T.G. Dinan Nature Rev. Neurosci. 13, 701-712 (2012) PubMed
10: Dinan T.G. et al. Biol. Psychiatry 74, 720-726 (2013) PubMed
"Now go consciously into the breath and let it go. Fully in, letting go, fully in, letting go." (Wim Hof)
χιλικάδο
Si prega Accesso a partecipare alla conversazione.
www.jneurosci.org/content/34/46/15490.full
Microbi Intestinali e Cervello: per un Cambiamento Paradigmatico nelle Neuroscienze
Emeran A. Mayer, Rob Knight, Sarkis K. Mazmanian, John F. Cryan, and Kirsten Tillisch
Estratto
La scoperta della portata e della complessità del microbioma umano si è tradotta in una rivalutazione continua di molteplici concetti di salute e malattia, incluse le malattie che colpiscono il sistema nervoso centrale (SNC). Una crescente raccolta di letteratura preclinica è riuscita a dimostrare la presenza di una segnalazione bidirezionale tra il cervello e il microbioma intestinale, che implica molteplici meccanismi di segnalazione di tipo neurocrino ed endocrino. Mentre i fattori di stress psicologici e fisici possono interessare la composizione e l'attività metabolica del microbiota intestinale, modifiche sperimentali su di esso possono influenzare il comportamento emotivo e i sistemi cerebrali correlati. Queste scoperte hanno portato alla speculazione che alterazioni della flora intestinale potrebbero giocare un ruolo fisiopatologico nelle malattie del cervello umano, fra cui i disordini dello spettro autistico, l'ansia, la depressione e il dolore cronico. Studi di popolazione a larga scala tuttora in corso sul microbioma intestinale, e indagini di neuroimaging che esaminano l'effetto della modulazione del microbiota intestinale sulle risposte del cervello a relativi stimoli emozionali, cercano di convalidare tali speculazioni. Questo articolo è un riassunto dei temi emergenti trattati in un simposio e non è concepito per essere una rassegna completa sull'argomento.
Introduzione
Tradizionalmente, i microrganismi non sono stati considerati di particolare importanza per lo sviluppo e per la funzione del SNC, o nella fisiopatologia delle malattie croniche del cervello, come ad esempio i disordini emotivi e dell'umore, il morbo di Parkinson o il morbo di Alzheimer. La notevole e spesso citata abilità del parassita Toxoplasmosi gondii di dirottare i sistemi cerebrali dell'ospite (es, ratto) connessi a comportamenti difensivi e di attrazione sessuale, per manipolarne il comportamento in modo da ottimizzare la riproduzione del parassita (House et al. 2011 ) è stato considerato una curiosa anomalia del dogma prevalente, che guarda esclusivamente al cervello per la ricerca delle cause del comportamento e delle malattie cerebrali. Un'eccezione alla visione tradizionale sono stati i disturbi dello spettro autistico (ASD), una malattia del cervello a lungo sospettata di essere collegata con una flora intestinale alterata (Mayer et al., 2014A), un concetto recentemente rivisto sia in modelli di roditori, che in soggetti umani. La visione del mondo “microbioma-free” delle neuroscienze è radicalmente cambiata con la scoperta e la caratterizzazione del microbioma umano e, in particolare, del microbioma intestinale (Human Microbiome Project Consortium, 2012). Sebbene le interazioni intestino-cervello siano state indagate per decenni, fornendo un gran numero di informazioni sulle stretta interazione tra il sistema immunitario intestino-associato, il sistema nervoso enterico e il sistema endocrino intestinale (Mayer, 2011), tali risultati sono stati in gran parte ignorati dalla comunità di ricerca psichiatrica e neurologica. La scoperta del microbioma intestinale ha aggiunto un elemento a lungo trascurato al complesso di segnalazioni bidirezionali tra mente, cervello, intestino e il suo microbioma, e sorprendentemente ha scatenato un enorme interesse da parte dei media professionisti e non, oltre che dalle agenzie nazionali di finanziamento, incluso l'Istituto Nazionale di Salute Mentale. L'iniziale scetticismo riguardo le evidenze che suggerivano un ruolo profondo di una flora intestinale integra nel plasmare la neurochimica del cervello e il comportamento emotivo, ha lasciato il posto a un cambiamento di paradigma senza precedenti nella concettualizzazione di molte malattie psichiatriche e neurologiche. Sebbene molti dei nuovi concetti siano basati principalmente su interessanti risultati sperimentali da roditori, iniziali ricerche sugli esseri umani sembrano supportare l'idea che ci sia una relazione tra il complesso mondo microbico nel nostro intestino e la struttura e la funzione del cervello. Anche se la maggior parte degli studi pubblicati riguardanti la segnalazione che il microbioma intestinale invia al cervello sono basati su analisi microbiche eseguite su campioni di feci, gli studi futuri quasi certamente amplieranno il campo delle indagini a campioni di mucosa prelevati da varie regioni del tratto gastrointestinale. In base alla nostra attuale e ancora limitata conoscenza riguardo queste interazioni intestino-microbioma-cervello, sono state proposte delle affascinanti speculazioni in un numero crescente di articoli di rassegna sull'argomento. Esse spaziano da termini come “psicobiotica” o microbi “malinconici” (Cryan e Dinan, 2012), alle concettualizzazioni per cui l'essere umano sarebbero solo il veicolo per i 100 trilioni di microrganismi che vivono dentro di noi. Quest'ultimo concetto è stato sviluppato con l'intrigante ipotesi che la flora intestinale abbia sviluppato dei meccanismi per “hakerarsi” nel nostro sistema di gratificazione, per farci desiderare alcuni alimenti e per evitarne altri, in modo da risultare per loro più vantaggiosi (Alcock et al., 2014). Allo stesso modo, interazioni microbo-cervello sono state recentemente proposte per essere un fattore chiave dell'evoluzione del cervello sociale (Stilling et al., 2014b). Il seguente articolo affronta alcuni aspetti in rapida evoluzione dell'argomento riguardante le interazioni intestino-microbioma-cervello, in rapporto allo stato di salute e di malattia (Fig. 1). Anche se non è una rassegna completa del tema, fornisce l'opportunità di dare un'occhiata a questa nuova ed emergente visione delle neuroscienze.
Il microbiota intestinale regola lo stress, l'ansia, e la cognizione: meccanismi e potenziale terapeutico
Un accumularsi di prove, per lo più da studi su animali, suggerisce che diversi tipi di stress psicologico possono influenzare la composizione della flora intestinale. Ad esempio, la separazione materna, condizioni di contenimento, affollamento, stress da calore e stress acustico, tutti quanti, alterano la composizione del microbiota intestinale (Bailey et al, 2011;.. De Palma et al, 2014;. Moloney et al, 2014). Inoltre, un numero crescente di dati suggerisce che il microbiota potrebbe essere coinvolto nel controllo dei comportamenti attinenti ai disturbi legati allo stress.
Varie condizioni sperimentali sono state utilizzate per studiare il ruolo del microbiota intestinale su modelli preclinici, incluse perturbazioni del microbioma intestinale da ingestione di probiotici e antibiotici, trapianto microbico fecale, e sono state fatte comparazioni dei comportamenti e delle risposte biologiche tra gli animali germ-free (cresciuti in un ambiente sterile dal momento della nascita) e quelli con un microbioma privo di agenti patogeni.
Animali privi di germi (Germ-free animals)
E' ormai passato un decennio da quando Sudo et al. (2004) scoprirono che i topi germ-free hanno una risposta dell'asse ipotalamo-pituitario-surrenale esagerata allo stress di contenimento, un effetto che è stato invertito dalla monocolonizazione di una particolare specie di Bifidobacterium. Questa osservazione fondamentale motivò un certo numero di gruppi di ricerca ad investigare il ruolo del microbiota intestinale dell'ospite nel funzionamento del SNC, con risultati convergenti e interessanti. Malgrado le risposte neuroendocrine esagerate allo stress, sono state osservate delle consistenti riduzioni dei comportamenti simili all'ansia [anxiety-like] nei topi germ-free esposti a fattori di stress ecologicamente più pertinenti, quali condizioni ambientali nuove e avverse (labirinto a croce elevato, scatola luce/buio, open field) (Diaz Heijtz et al, 2011;.. Neufeld et al, 2011; Clarke et al, 2013). Questo fenotipo era suscettibile di inversione quando gli animali venivano colonizzati nei primi momenti di vita (Clarke et al., 2013). Curiosamente recenti studi su animali germ-free nel ceppo di ratti F344 sensibili allo stress mostravano simili risposte neuroendocrine esagerate, ma hanno anche rivelato un aumento dei comportamenti anxiety-like (Crumeyrolle-Arias et al., 2014). Inoltre, è stato recentemente dimostrato che la colonizzazione a breve termine di topi germ-free riduce i comportamenti anxiety-like in età adulta (Nishino et al., 2013). Presi insieme, risulta allora chiaro, che gli studi sugli animali germ-free mostrano chiaramente una relazione tra la flora intestinale, lo stress e comportamenti legati all'ansia, la natura di questo rapporto viene influenzata da fattori temporali, di specie e altri, legati al sesso e al ceppo, non ancora del tutto compresi.
Un numero crescente di studi stanno anche indagando i cambiamenti dell'espressione genica in diverse regioni del cervello in topi germ-free. Più comunemente, diminuzioni nell'espressione ippocampale del BDNF, una proteina chiave coinvolta nella plasticità neuronale e nella cognizione, sono state osservate nei topi germ-free rispetto a esemplari di controllo allevati normalmente, o resi convenzionali (es. topi inizialmente germ-free che vengono poi colonizzati con il normale microbiota intestinale di topo). Simili cambiamenti nell'espressione del'BDNF sono stati riportati anche a seguito della somministrazione di antibiotici (Bercik et al., 2011b). Alterazioni nella segnalazione neuronale, che include i neurotrasmettitori, i metaboliti associati e i recettori dei neurotrasmettitori, sono stati anche descritti in specifiche regioni del cervello dei topi germ-free. Diaz Heijtz et al. (2011) adottarono un approccio trascrittomico genome-wide [sull'intero genoma] che mostrava come i geni associati al ciclo dell'acido citrico (potenziamento sinaptico a lungo termine, metabolismo degli ormoni steroidei e segnalazione ciclica adenosina 5-fosfato-mediata) erano sovra regolati in topi germ-free. È interessante notare che, in questi studi il cervelletto e l'ippocampo hanno robusti cambiamenti nell'espressione genica, ma l'ipotalamo, la regione del cervello coinvolta nella risposta allo stress, non mostrava pressoché nessuna espressione genica differenziale.
Alcuni parametri comportamentali e biochimici (tra cui l'ansietà, la socialità, l'asse ipotalamo-pituitario-surrenale, e il metabolismo del triptofano) potevano essere invertiti nel topo germ-free da una ricolonizzazione di microbiota comune o da un trattamento probiotico, altri invece non venivano influenzati dal ripristino di un microbiota normale (fra cui la concentrazione di 5-HT e la cognizione sociale) (Stilling et al., 2014A). Infatti, si è pensato che la reversibilità del fenotipo ansiolitico nei topi germ-free possa certamente accadere solo se la ricolonizzazione avviene durante una finestra temporale critica nel corso delle prime fasi di vita o nell'adolescenza (Neufeld et al, 2011;. Clarke et al 2013). Tale assunto è stato recentemente messo in discussione dall'evidenza che la colonizzazione sull'adulto influenza le condotte anxiety-like (Collins et al, 2013;. Nishino et al 2013).
E' importante notare che gli studi germ-free hanno una traducibilità clinica limitata. La somministrazione di antibiotici nelle fasi post-natali sui roditori non ricapitola molti dei fenotipi comportamentali germ-free (O'Mahony et al., 2014). Un fattore che contribuisce a questa limitata attinenza traslazionale è il fatto che gli animali germ-free mostrano considerevoli alterazioni della funzione gastrointestinale, fra cui una dilatazione complessiva del colon prossimale e alterazioni nella motilità e nel sistema immunitario, il quale ha presumibilmente anche importanti effetti sul cervello. Ciononostante, gli studi germ-free sono dei mezzi potenti in quanto provano in maniera definitiva che il microbiota è coinvolto nell'ambito di un aspetto specifico del funzionamento cerebrale. I topi germ-free consentono anche lo studio isolato degli effetti di un particolare intervento batterico o dietetico sull'asse microbiota-intestino-cervello. Le indagini sui topi germ-free possono anche essere ampliate al fine di consentire la ricerca sulla “umanizzazione” del microbiota intestinale (vale a dire, il trapianto di microbiota fecale da specifiche condizioni umane o da modelli animali di malattia). A questo proposito, affascinanti studi hanno dimostrato che il trapianto di microbiota da un ceppo di topi a elevata-ansietà, ad un destinatario germ-free a bassa-ansiaetà in età adulta, era sufficiente ad incrementare l'ansia nel ricevente, e risultava vero anche con la procedura inversa (Collins et al ., 2013). Questi studi supportano anche il concetto che il comportamento degli animali germ-free è suscettibile di modifiche anche in età adulta. Un'ulteriore prova della trasferibilità su base microbica del comportamento viene da un recente studio dove ai topi, il cui microbiota basale era stato ablato con antibiotici, veniva dato il microbiota da donatori animali che erano stati nutriti con una dieta ricca di grassi. Questi topi avevano disturbi comportamentali selettivi di tipo esplorativo, cognitivo e stereotipico, rispetto ai topi trapiantati con un microbiota di controllo e in assenza di differenze significative del peso corporeo (Bruce-Keller et al., 2014).
Probiotici
Una crescente raccolta di prove provenienti da studi sui roditori supporta ulteriormente il ruolo del microbioma intestinale nel modulare il comportamento emotivo. Una serie di probiotici sono stati indagati in modelli animali. Bifidobacterium e Lactobacillus sono i principali generi batterici che mostrano degli effetti benefici sui comportamenti simili all'ansia e alla depressione. Tuttavia, anche all'interno di generi batterici, in un determinato ceppo, si verificano differenze, e solo alcuni ceppi hanno effetti positivi (Dinan et al., 2013). Il trattamento cronico con Bifidobacterium Infantis attenuava i cambiamenti immunitari postnatali indotti da stress e i comportamenti depressivi in età adulta (Desbonnet et al., 2010). Il Lactobacillus helveticus ROO52 ha mostrato di saper ridurre il comportamento anxiety-like e alleviare la disfunzione della memoria (Oh Land et al., 2013). Il Lactobacillus rhamnosus JB-1 riduceva i comportamenti relativi all'ansia e alla depressione rispettivamente nel test del labirinto a croce elevato e nel test del nuoto forzato (Bravo et al., 2011). Un recente lavoro di Matthews e Jenks (2013) dimostrava ansietà ridotta e migliori prestazioni in una prova di labirinto complesso dopo il trattamento con Mycobacterium vaccae vivo.
Bifidobacterium longum normalizza il comportamento ansiogeno in un modello di colite (Bercik et al., 2011a). Inoltre, un ceppo di B. longum ma non di L. rhamnosus, normalizzava il comportamento ansiogeno infezione-indotto (Bercik et al., 2010). Una combinazione di L. rhamnosus e L. helveticus invertiva la disfunzione della memoria indotta da stress nei topi infettati da Citrobacter rodentium (Gareau et al., 2011). Più di recente, è stato dimostrato che VSL # 3 (una miscela di otto diversi probiotici) era in grado di invertire i deficit associati all'età in long-term potentiation (LTP, potenziamento a lungo termine), il correlativo elettrofisiologico della formazione della memoria (Distrutti et al., 2014). Il trattamento probiotico si è dimostrato efficace per alleviare le risposte al dolore viscerale nei modelli animali (Rousseau et al, 2007;. McKernan et al., 2010). Un'altra possibile strategia per modulare l'asse microbioma-intestino-cervello è l'uso di prebiotici, ovvero ingredienti alimentari non digeribili, che promuovono la crescita di microrganismi intestinali benefici (probiotici). Incredibilmente, c'è stata una carenza di studi dei prebiotici sugli animali o sugli esseri umani, benché specifici prebiotici abbiano dimostrato di aumentare i livelli di BDNF del cervello (Savignac et al., 2013).
Complessivamente, l'accumulo di prove da studi fatti sui roditori suggerisce che ci sono collegamenti tra la composizione del microbiota, la biochimica del cervello e il comportamento, e che queste interazioni potrebbero essere particolarmente importanti durante finestre temporali critiche dello sviluppo neurologico (Borre et al., 2014). I meccanismi molecolari sottostanti che conducono a queste alterazioni comportamentali e biochimiche non sono ben compresi. I metaboliti batterici includono molti agenti neuroattivi (Lyte, 2013;. Wall et al, 2014), e la comprensione dei componenti specifici del metaboloma microbico sarà importante per la comprensione del ruolo del microbioma nella salute del cervello e nella malattia (Holmes et al 2012). Curiosamente, vi è ora un crescente apprezzamento del ruolo dei meccanismi epigenetici nella formazione del cervello e del comportamento, e vale la pena notare che molti metaboliti batterici possono agire come modificatori epigenetici (Stilling et al., 2014A).
Prove di alterazioni nelle interazioni intestino-microbioma-cervello su un modello roditore di ASD
Alterazioni nella comunicazione tra il microbioma intestinale e il cervello, che includono le modifiche nella composizione e nei prodotti metabolici del microbioma intestinale, sono stati implicati nella complessa fisiopatologia dei ASD. I sintomi gastrointestinali sono una comune comorbidità nei pazienti con ASD, anche se i meccanismi alla base rimangono in gran parte sconosciuti. Sono stati proposti diversi tipi di modelli roditori per ASD umano: (1) ceppi di roditori già presenti in natura che dimostrano tratti comportamentali attinenti ai ASD; (2) modelli che esprimono una mutazione genetica umana associata con i ASD; e (3) modelli con comportamenti acquisiti derivanti da vari traumi ambientali, o che interessano direttamente l'animale in via di sviluppo, o che riguardano la madre di prole con ASD (Desbonnet et al 2014. de Theije et al 2014). In uno di questi modelli prenatali indotti, l'esposizione di tope gravide trattate con acido valproico si risolve in comportamento ASD-like nella prole, connesso con alterazioni del microbioma intestinale associate con variazioni infiammatorie ed endocrine, sia nel tratto intestinale e che nel sistema nervoso.
Inoltre collegando il microbiota ai ASD, i topi germ-free mostravano una ridotta socialità ed avevano deficit di cognizione sociale nel three-chamber test ed esibivano un accresciuto comportamento di grooming ripetitivo rispetto alle loro normali controparti (Desbonnet et al., 2014). È interessante notare che i deficit in socialità e i comportamenti ripetitivi, ma non la cognizione sociale, venivano invertiti da una colonizzazione post-svezzamento. Recenti e stimolanti indagini puntano alla capacità di un ceppo di Bacteroides fragilis, somministrato nelle prime fasi di vita post-svezzamento, di invertire i cambiamenti gastrointestinali, del microbiota e dei comportamenti selettivi, indotti su un modello di infezione prenatale per disordini dello sviluppo neurologico, come i ASD e la schizofrenia (Hsiao et al., 2013).
In generale, c'è un'intrigante evidenza preclinica e alcune prove cliniche che implicano delle alterazioni del microbioma intestinale nella fisiopatologia dei ASD. Tuttavia, resta da determinare se i cambiamenti del microbiota osservati siano secondari alla regolazione neurale alterata (CNS, sistema nervoso enterico) delle funzioni intestinali chiave (motilità, secrezione), oppure se essi rappresentano alterazioni periferiche primarie che influenzano lo sviluppo e la funzione del cervello (Mayer et al., 2014A). Come i ASD sono un gruppo eterogeneo di malattie, è improbabile che un solo meccanismo patologico (come l'alterazione della flora intestinale e della segnalazione cerebrale) possa essere applicata a tutti i fenotipi della malattia.
La segnalazione del microbiota intestinale negli esseri umani
Sebbene la nostra capacità di studiare le interazioni intestino-microbioma-cervello rimanga molto più limitata negli esseri umani di quanto non lo sia nei modelli preclinici, è possibile ottenere un'ampia visione della composizione del microbiota intestinale e dei metaboliti mediante l'analisi di campioni fecali e puntando a correlare questi risultati con l'attività e la struttura cerebrale mediante il neuroimaging (Tillisch e Labus, 2014). Inoltre, la modulazione della flora gastrointestinale nell'uomo con alimenti, integratori (ifra cui probiotici e prebiotici), o farmaci (compresi gli antibiotici) possono essere utilizzati come sonde sperimentali per ulteriori studi meccanicistici riguardo le interazioni microbiche tra cervello e intestino (Mayer et al., 2014b)
Modulazione dell'asse intestino-cervello tramite antibiotici
La manipolazione dei batteri intestinali con antibiotici viene utilizzata clinicamente per migliorare la funzione cerebrale nell'encefalopatia epatica, una complicanza della epatopatia cronica (Butterworth, 2013). I pazienti con encefalopatia epatica hanno alterazioni variabili nella funzione cognitiva, presumibilmente dovute ai metaboliti microbici intestinali che non vengono efficacemente eliminati dal fegato malato. In pazienti con encefalopatia epatica lieve, otto settimane di trattamento orale con un antibiotico non assorbibile, erano associate a miglioramenti nella funzione cognitiva sulla base di una serie di test standardizzati (Bajaj et al., 2013). Questi cambiamenti cognitivi avvenivano in assenza di ulteriori alterazioni nella composizione del microbioma complessivo, da analisi dei suoi componenti principali. Tuttavia, venivano rilevati cambiamenti metabolomici nel siero. Gli acidi grassi a catena corta, un importante prodotto metabolico del microbiota intestinale con effetti ben conosciuti sul sistema nervoso, venivano aumentati (Haast e Kiliaan, 2014). Gli autori ipotizzavano che i mutamenti nei profili degli acidi grassi nella periferia avrebbero potuto corrispondere a profili più favorevoli degli acidi grassi del cervello, come un meccanismo per una cognizione migliorata. Il trattamento con lo stesso antibiotico dell'encefalopatia epatica in uno studio open-label era associato a un'alterata connettività funzionale durante un compito cognitivo, e a mutamenti nella integrità della sostanza bianca (come misurato dalla anisotropia frazionale) (Ahluwalia et al., 2014). Questi cambiamenti supportano un precedente lavoro su modelli animali, nel quale il trattamento antibiotico era stato associato sia ad alterazioni comportamentali, sia a variazioni nella neurochimica (Bercik et al., 2011b). Sorprendentemente, malgrado l'ampio uso di antibiotici e le descrizioni cliniche degli effetti collaterali di tipo cognitivo e psichiatrico, c'è stata una scarsa valutazione del ruolo degli antibiotici nell'asse microbioma-cervello umano (Sternbach e Stato, 1997; Tomé e Filipe, 2011).
Modulazione dell'asse intestino-cervello tramite probiotici
I probiotici sono largamente utilizzati, e come prodotti di consumo, rappresentano in tutto il mondo più di 20 miliardi di dollari. Comunque, a dispetto delle affermazioni ormai numerose e prive di fondamento, effetti probiotici sulla struttura e sulla funzione del microbiota intestinale umano sono stati studiati soltanto in alcuni ceppi specifici, e la nostra comprensione dei loro effetti sui sintomi clinici è tutt'altro che completa (Sanders et al., 2013). Diversi probiotici hanno mostrato di avere un'utilità per specifici sintomi gastrointestinali e per specifici sintomi globali nella sindrome del colon irritabile, una condizione di dolore cronico caratterizzata da deregolazione dell'asse cervello-intestino (Moayyedi et al, 2010;.. Mayer et al, 2014b). Non è ancora noto se tali benefici siano dovuti principalmente ad azioni periferiche nell'intestino, o ad effetti centrali. Nella sindrome da stanchezza cronica, un altro disturbo delle interazioni cervello-corpo, un trial placebo-controllato, a doppio cieco e randomizzato, di un probiotico contenente Lactobacillus permetteva di diminuire l'ansia, ma non i sintomi di depressione nel gruppo di trattamento attivo, e incrementava l'abbondanza relativa di Bifidobacterium e Lactobacillus nelle feci (Rao et al., 2009). Questo studio, pubblicato come un breve report, è poco dettagliato nel riportare i risultati, quindi dovrebbe essere interpretato con cautela. Sono stati pubblicati due brevi indagini degli effetti dei probiotici sull'umore e sulla cognizione in individui sani, entrambi i quali suggeriscono un effetto sull'asse microbioma-cervello. Nel primo, un probiotico contenente Lactobacillius e Bifidobacterium era confrontato con un placebo in volontari sani, misurando i sintomi umorali con l'Hospital Anxiety and Depression Scale. La diminuzione percentuale nel punteggio totale dell'Hospital Anxiety and Depression Scale era maggiore nel gruppo probiotico, ma non nelle sottoscale (Messaoudi et al., 2011). Una riduzione del cortisolo urinary-free veniva anche rilevata durante il trattamento nel gruppo probiotico, ma non nel gruppo placebo, sebbene la differenziazione di gruppo non fosse significativa. In questo studio, gli autori mettevano in atto un ramo sperimentale del trattamento probiotico nei roditori, e in accordo con i risultati umani, ha visto il miglioramento delle prestazioni comportamentali in una prova anxity-like. Nel secondo studio, gli effetti di una bevanda lattiera contenente Lactobacillus sono stati confrontati con il placebo, senza significativi cambiamenti complessivi nell'umore, misurato dal Profile of Mood States (Benton et al., 2007). Gli autori suggeriscono che questa assenza di effetti potrebbe essere dovuta allo stato d'animo positivo globale del campione, e hanno notato un lieve effetto quando si guardava ad un piccolo sottogruppo di soggetti post hoc sul terzile più basso degli stati d'animo. Sorprendentemente, questo stesso studio ha mostrato per i gruppi probiotici dei punteggi minori riguardo la memoria, rispetto al gruppo placebo. Anche se queste indagini suggeriscano nel loro complesso un potenziale posseduto da alcuni probiotici d'incidere positivamente sull'umore, saranno necessari, per trarre conclusioni più chiare, test clinici su popolazioni di pazienti ben progettati, più estesi e idealmente con risultati biologici e autovalutativi.
L'imaging del cervello durante le interazioni intestino-microbioma-cervello
Benché siano importanti da un punto di vista meccanicistico, la maggior parte degli studi preclinici hanno usato interventi sperimentali non fisiologici (es, animali germ-free), concetti semplificati di emozioni umane complesse (ansia e depressione), e sono spesso basati su presupposti errati circa l'omologia anatomica e funzionale del roditore e dei cervelli umani (in particolare la corteccia prefrontale e l'insula anteriore). Perciò, non è ancora chiaro quale sarà il valore traslazionale dei risultati ottenuti in questi modelli di roditori per comprendere i disordini cerebrali o cervello-intestinali negli esseri umani. Chiaramente, sono necessari ulteriori studi sull'uomo per verificare alcune delle intriganti scoperte fatte sugli animali. fMRI [risonanza magnetica funzionale] può essere utilizzata negli esseri umani per osservare i cambiamenti nella risposta del cervello dopo interventi probiotici o antibiotici, così come viene solitamente utilizzata per testare farmaci o interventi comportamentali (Mayer et al., 2002; Wise e Tracey, 2006;. Tillisch et al, 2008). Gli effetti dell'assunzione giornaliera di probiotici sulle risposte cerebrali a un test di riconoscimento delle emozioni sono stati descritti in donne sane (Tillisch et al., 2013). In questo studio, donne senza sintomi gastrointestinali, dolori, o disturbi psichiatrici, venivano randomizzate al trattamento con un probiotico assunto da un prodotto caseario non fermentato, o non trattato. La reazione alle espressioni facciali negative, in una prova di riconoscimento emotivo, veniva misurata con l'fMRI prima e dopo il periodo di trattamento. Paragonato a entrambi i gruppi di controllo, quello probiotico mostrava, in risposta al compito, riduzioni nell'insula e specialmente nella corteccia somatosensoriale, oltre che attraverso una rete funzionale diffusa che includeva le regioni emotive e sensoriali. Benché siano possibili interpretazioni alternative, questi risultati potrebbero essere la rappresentazione di una riduzione della vigilanza nei confronti di stimoli ambientali negativi in soggetti che consumano regolarmente probiotici. I cambiamenti nell'attività cerebrale erano indipendenti dai sintomi gastrointestinali autovalutati, indicando che l'effetto centrale non era probabilmente dovuto a un migliore senso di benessere digestivo. Confermando i risultati di uno studio precedente con dettagliate analisi microbiche e metabolomiche (McNulty et al., 2011), non venivano osservati cambiamenti gruppi-specifici nell'architettura complessiva del microbiota dopo quattro settimane di ingestione di probiotici, sebbene i campioni di feci abbiano dato conferma che i ceppi probiotici specifici erano presenti nel gruppo trattato. Questo è in accordo con l'ipotesi che, perlomeno nel breve termine, metaboliti microbici, anziché la configurazione microbica complessiva, possano essere il risultato saliente dell'ingestione di probiotici (McNulty et al., 2011). Neuroimaging funzionali e strutturali, insieme a misurazioni metabolomiche e metagenomiche da feci, saranno essenziali nel contribuire a una migliore comprensione di come funziona l'asse intestino-microbioma-cervello nella salute e della malattia umana.
L'integrazione dei dati multilivello del cervello e dei dati correlati al microbioma
Progressi negli approcci computazionali sono urgentemente necessari per comprendere meglio i legami tra il microbiota intestinale e il cervello. Di particolare importanza sono gli strumenti per integrare grandi insiemi di dati altamente multivariati (Gonzalez e cavaliere, 2012;. Navas-Molina et al, 2013). Questi set di dati includono profili tassonomici ottenuti dal sequenziamento dell'amplicone di rRNA 16S o shotgun metagenomics, cataloghi genetici da shotgun metagenomics, set di dati dell'espressione da sequenziamento mRNA o proteomica, profili dei metaboliti da metabolomica mirata o non mirata, insiemi di dati comportamentali e dati di imaging, tra cui la risonanza magnetica strutturale e funzionale. Sempre di più, questi insiemi di dati comportano anche elementi di serializzazione temporale, soprattutto perché i metodi di acquisizione dati stanno diminuendo nei costi (per esempio, il profiling dell'amplicone dell'rRNA 16S è diminuito in termini di costi pressoché di un fattore di un milione nel corso dell'ultimo decennio) (Kuczynski et al. 2012). Poiché le tecniche di analisi dei dati in ciascuno di questi settori stanno individualmente evolvendo rapidamente, la loro integrazione rimane ancor di più un bersaglio in movimento.
Molte connessioni tra microbioma e cervello potrebbero essere state trascurate perché altre vie causali sembravano inizialmente più plausibili. Ad esempio, topi knock-out di TLR5, in alcuni sistemi, aumento di peso rispetto ai topi wild-type con la stessa dieta, oltre a sviluppare una sindrome metabolica. Questo effetto scompare quando i topi vengono allevati in maniera germ-free, e quando possono essere trattati con antibiotici. E' affascinante che il meccanismo sia comportamentale: in ambienti obesogenici, i topi knock-out di TLR5 hanno una comunità microbica alterata che può essere trasmessa anche a topi wild-type geneticamente normali, allevati in maniera germ-free. Tale comunità microbica alterata causa un mutamento nella condotta ingestiva (ad esempio, iperpagia: l'obesità può essere prevenuta e invertita mettendo nella gabbia solo la quantità di cibo che un topo wild-type vorrebbe mangiare) (Vijay-Kumar et al., 2010). Sebbene il meccanismo che conduce a questo effetto resti sconosciuto, particolari specie di batteri nell'intestino sono noti per influenzare i livelli degli ormoni che regolano l'appetito, fra cui la leptina (Ravussin et al., 2012) e la grelina (Queipo-Ortuño et al., 2013). Allo stesso modo, gli effetti probiotici di L. rhamnosis sull'espressione ospite dei recettori GABA richiedono un nervo vago intatto (Bravo et al., 2011). La possibilità di molti altri fenotipi microbicamente indotti di intervenire tramite meccanismi comportamentali, tra cui la segnalazione neurale, è quindi immensa e al momento poco esplorata.
Strumenti per il monitoraggio delle dinamiche del microbioma sono in rapida evoluzione (Caporaso et al, 2011;.. Vázquez-Baeza et al, 2013) e forniscono intuizioni sia per quanto riguarda una normale variazione del microbioma, che nei suoi mutamenti nelle risposte alle terapie, inclusi gli antibiotici (Lozupone et al., 2013) e il trapianto fecale di microbiota (Khoruts A, Sadowsky M, University of Minnesota, dati non pubblicati). Questi strumenti possono essere facilmente estesi ad altri insiemi di dati multivariati, comprese le caratteristiche derivate dalla serie di dati di imaging, attraverso l'uso del formato file Biological Observation Matrix (McDonald et al., 2012). Fondamentalmente, la tecnica è quella di utilizzare una vasta popolazione, similmente all'Human Microbiome Project Consortium (2012), come una cornice di dati, quindi proiettare le serie temporali corrispondenti a uno o più individui come animazioni in quella cornice, registrando anche funzioni derivate, quali la variabilità nel tempo, la direzione del cambiamento nello spazio multivariato, etc. (Carvalho et al., 2012).
L'American Gut Project
Un opportunità particolarmente interessante è fornita dall'American Gut Project, che utilizza crowdsourcing (ottenendo campioni e/o assistenza all'analisi dei dati da parte dei membri del pubblico) e il crowdfunding (acquisire un sostegno finanziario da parte dei membri del pubblico) per ottenere migliaia di campioni fecali (e di altro), e analizzare le comunità batteriche contenute in tali campioni. Diversi studi hanno dimostrato che la conservazione dei campioni non sterilizzati a temperatura ambiente non altera i principali risultati microbiologici (es, il raggruppamento dei campioni dallo stesso soggetto) (Lauber et al, 2010;.. Wu et al, 2010). Sebbene ci siano nello stesso individuo delle difformità tra la composizione microbica fecale e quella di altri siti distali del intestino crasso, queste differenze sono minori rispetto a quelle che intercorrono fra soggetti, e così, tali campioni forniscono una buona lettura dell'intestino crasso distale (sebbene sia risaputo che l'intestino tenue differisce sostanzialmente nella sua microbiologia) (Eckburg et al, 2005; Hamady e Knight, 2009; Gevers et al, 2014). Al momento in cui scriviamo, l'American Gut Project ha pubblicamente rilasciato dati di sequenziamento da quasi 4000 campioni microbici prelevati dai membri del pubblico. Questa serie di dati ci permette facilmente di integrare altre informazioni provenienti da popolazioni cliniche, mentre sono in corso altri studi specializzati sulla depressione, i ASD, la sindrome del colon irritabile e la celiachia (entrambe delle quali hanno comorbilità sostanziale con la depressione), la sclerosi multipla e le altre condizioni che interessano il sistema nervoso, in cui i microbi sono noti per essere coinvolti negli esseri umani e in modelli di topo, o, dove esistono plausibili, anche se speculativi, canali di comunicazione. In particolare, la disponibilità di metodi per correlare diversi tipi di dati, e di integrare dettagliate serie temporali, compresi i cicli di remissione e ricaduta, o gli effetti di trattamenti specifici, forniscono una sostanziale speranza per identificare nuove maniere di stratificare i pazienti e nuove modalità di trattamento.
In conclusione, la scoperta e l'esplosivo progresso nella caratterizzazione del microbioma intestinale hanno avviato un cambiamento paradigmatico non solo in medicina, ma anche nei domini di base e clinici delle neuroscienze. Per comprendere la portata di questo cambiamento di paradigma, bisogna ricordare al lettore la possente influenza della separazione Cartesiana tra mente/cervello da una parte (religione, psichiatria) e il corpo dall'altra (medicina) che ha dominato la scienza occidentale e la medicina per centinaia di anni. Non solo il concetto di interazione tra intestino, microbioma e cervello, nella salute e nella malattia, rappresenta una rottura paradigmatica, ma le stesse metodologie analitiche informatiche che stanno emergendo, e che sono necessarie per perseguire l'integrazione di grandi quantità di dati, sono altrettanto rivoluzionarie. E' difficile prevedere il corso di questa eccitante scoperta: il microbioma intestinale aggiungerà nuove intuizioni paradigmatiche alla nostra attuale comprensione del funzionamento del cervello umano durante lo stato di salute e si malattia, con conseguenti nuove terapie, o rappresenterà solo un passo progressivo nella comprensione del funzionamento interno dei nostri cervelli? I prossimi anni di ricerca consentiranno forse di scoprire, le interessanti connessioni tra i batteri intestinali e le condizioni neurologiche che potrebbero eventualmente influenzare la salute umana.
Note finali
Questo lavoro è stato supportato dal National Institutes of Health / National Institute of Diabetes and Digestive and Kidney Diseases Grant R01 DK048351 a EAM, Grant P30 DK041301, National Institutes of Health / National Institute of Mental Health Grant R01 MH100556 a SKM, Autism Speaks to SKM, Simons Foundation Programma SFARI a SKM e Howard Hughes Medical Institute a RK
Gli autori non dichiarano conflitti di interessi.
La corrispondenza deve essere indirizzata al Dr. Emeran A. Mayer, Università della California, Los Angeles, CHS 42-210, MC737818, 10833 Le Conte Avenue, Los Angeles, CA 90095-7378. emayer@ucla.edu
"Now go consciously into the breath and let it go. Fully in, letting go, fully in, letting go." (Wim Hof)
χιλικάδο
Si prega Accesso a partecipare alla conversazione.